Раскрыт секрет «мышечной памяти»!

Перевод - Струков С.
Тренированные люди при возобновлении занятий быстрее увеличивают силу (1,2), этот широко известный феномен называется «мышечная память». Механизмы памяти мышечных клеток не изучены, и до сегодняшнего дня долговременный эффект предыдущих тренировок объясняли моторной памятью центральной нервной системы (3). Тем не менее, было показано, что мышцы способны сохранять гипертрофию после нескольких месяцев детренировки (1, 4- 8). В одном исследовании у пожилых людей, занимавшихся силовой тренировкой, сила оставалась на 9 – 14% выше даже после 2 лет детренировки (7). За 30-32 недели детренировки группа женщин утратила значительную часть силы, приобретённую в итоге 20 недель тренировок, но восстановила результаты всего за 6 недель «ретренировки» (1). Этот факт свидетельствует о пользе локализации механизма памяти в мышцах. Вызванная тренировкой гипертрофия остаётся в виде изменения архитектуры клетки даже после последующего продолжительного неиспользования.
Уже более ста лет известно, что ядра могут обеспечивать только определённый объём цитоплазмы (9 - 19). Мышечное волокно является одним из немногочисленных видов многоядерных клеток и может в пять раз превышать по размеру одноядерную клетку (18). Раньше считали, что в случае увеличения в размере мышечного волокна, ядра добавляются за счёт митоза и последующего слияния стволовых мышечных клеток, а при атрофии некоторые «избыточные» ядра удаляются путём селективного апоптоза (20, 21). Такой механизм служит для поддержания постоянного размера цитоплазматического ядерного домена.
Недавно разработанная техника замедленной съёмки in vivo позволила внести ясность в эту простую модель, показав, что во время атрофии сохраняется нормальный уровень миоядер (22). Тем не менее, эта ситуация может отличаться при гипертрофии мышц, потому что в мышечной ткани происходит митоз во время увеличения мышечной массы, частично подверженный апоптозу при последующем неиспользовании (23). Согласно последним данным, образованные в результате «перегрузки» новые ядра остаются, по крайней мере, спустя 3 месяца денервации. Эти изменения позволяют сделать предположения относительно «памяти» мышечных клеток.
Обсуждение результатов
Нами показано, что добавление новых ядер предшествует увеличению размеров волокна при гипертрофии вследствие перегрузки, и таким образом, связано с более высокой способностью к синтезу белка при большем количестве ядер. Увеличенное количество ядер остаётся вне зависимости от поддержания гипертрофии, потому что их число поддерживается, несмотря на существенную атрофию вследствие трёх месячной денервации.
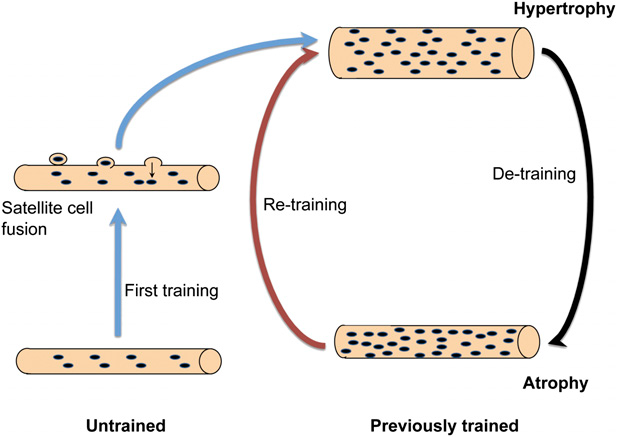
Рис. Модель, показывающая связь между размером мышц и количеством ядер. Здесь количество ядер постоянное. Прежде нетренированные мышцы добавляют новые ядра путём слияния с сателлитными клетками, что предшествует гипертрофии. При детренировке атрофия происходит без утраты ядер. Повышенное количество ядер в мышечных волокнах, которые подвергались гипертрофии, представляют основу «мышечной памяти», объясняя долговременное влияние тренировки и облегчая достижение тренированности при возобновлении занятий.
Наши данные противоречат простой парадигме о существовании неизменного миоядерного домена, в котором ядра, добавленные в период гипертрофии, утрачиваются во время атрофии. Таким образом, предложена другая модель (см. рис), согласно которой нетренированные волокна добавляют новые ядра как «первый источник тренированности». Эти добавленные ядра связаны с последующим увеличением волокон, например, ограниченная синтетическая способность каждого ядра может лимитировать поддержание большего объёма без увеличения числа ядер. При последующей детренировке поддерживается увеличенное количество ядер, что может противодействовать атрофии при возобновлении тренировок, увеличение размеров волокон способно происходить при умеренном увеличении белкового синтеза каждого из этих множества ядер, «пропуская» этап образования новых ядер. Последнее может обуславливать относительное укорочение пути при ретренировке по сравнению с людьми, прежде не тренировавшимися.
Идея об устойчивом увеличении ядер после силовой тренировки может служить поводом для рекомендаций к выполнению силовых упражнений на протяжении жизни. Мышечная слабость в пожилом возрасте является главной проблемой здоровья (27, 28), и гипертрофия, вызванная перегрузкой, существенно ослаблена у старых животных (29, 30). Количество ядер может выступать лимитирующим фактором (31). Показано, что активация сателлитных клеток подавляется в старости, что предположительно связано с межклеточной Notch сигнализацией (32,33). Наши наблюдения свидетельствуют о пользе «накачки» мышечных волокон ядрами с помощью упражнений перед физиологическим старением. Анаболические стероиды увеличивают количество ядер (34, 35), таким образом, преимущества от использования стероидов перманентное, и это должно отражаться на времени дисквалификации после допингового преступления.
Наиболее вероятным источником дополнительных ядер в период начала тренировок являются сателлитные клетки (36 - 38). Наш метод позволил провести детальный временной анализ и продемонстрировать наиболее интенсивное добавление ядер на 6 – 9 день после перегрузки. Это соответствует предыдущим наблюдениям, где стимул к гипертрофии вызывал митоз сателлитных клеток перед этим периодом (39 - 41). Увеличение общего синтеза белка (так же, как и деградации) отмечается в пределах нескольких часов после гипертрофического стимула (42 - 45), включая и нашу модель гипертрофии (46, 47). Это ведёт к предположению, что повышение удельной синтетической способности предшествует добавлению ядер, и увеличение количества ядер необязательно при гипертрофии. В нашем эксперименте размер ядерного домена уменьшался во время фазы роста и оставался пониженным, по крайней мере, 12 дней, показывая, что даже если синтез белка в каждом ядре увеличен в ранней стадии гипертрофии, этот механизм не является основным для увеличения размеров клетки. Наши данные свидетельствуют, что увеличение количества ядер – главная причина гипертрофии. Это, тем не менее, не исключает некоторую гипертрофию, которая может происходить без добавления ядер, например, в экспериментальных условиях, обсуждаемых ранее (48 - 59), в которых сателлитные клетки удалены.
Always et al (23) провели эксперимент, подобный нашему, в котором изучали влияние разгрузки предварительно перегруженных клеток мышц перепелов. Комбинируя окрашивания BrdU и TUNEL, они показали, что ядра в мышечной ткани, подвергшиеся митозу во время гипертрофии, отчасти склонны к апоптозу, и, основываясь на этом наблюдении, заключили, что популяция ядер при гипертрофии непостоянна и менее стабильна. Этот вывод противоречит нашим наблюдениям, но в большинстве их экспериментов не различали ядра миоцитов и других клеток мышечной ткани. Был показан только один пример апоптозных ядер внутри кортикального дистрофинового слоя, о частоте апоптозов обнаруженных миоядер не сообщалось.
В дополнение к представленному эксперименту с детренировкой, несколько исследований атрофии не обнаружили утрату ядер или миоядерного апоптоза (22, 60, 61). Учитывая методологические ограничения результатов, полученных при традиционной гистологии (61), на сегодняшний день нет достаточных доказательств, что ядра могут утрачиваться в интактных мышечных волокнах.
Источник: https://www.pnas.org/














