Белковый обмен и физическая тренировка. Часть 2

Окончание статьи.
Начало статьи здесь
Инсулин для регулирования обмена белка
Инсулинизвестен как регулятор обмена мышечных белков; однако не выяснен способ, посредством которого инсулин способствует анаболизму скелетных мышц у человека. Согласно имеющимся данным, инсулин активирует несколько белков (например, фосфатидилинозитол-3-киназу (PI3K)), которые вызывают фосфорилирование нижележащих сигнальных молекул, играющих ключевую роль в регуляции синтеза белков и гликогена (50). Кроме того, инсулин известен ослаблением убиквитинового протеолиза (95), который предположительно отвечает за деградацию многих мышечных белков (116), а также может через активацию калпейн или каспазы разрушать миофибриллы, в которых содержатся большинство белков скелетных мышц (91).
Несколько исследований непосредственно оценивали влияние инсулина на обмен белка при упражнениях с отягощениями. После упражнений с отягощениями натощак проявляется небольшое дополнительное влияние инсулина на СМБ (5, 41). Вероятно, это обусловлено пониженной доступностью аминокислот внутри клетки, поскольку инсулин уменьшает вызванное тренировкой повышение РМБ (5). В экспериментах, где после тренировки с отягощениями потребляли углеводы, также сообщали о снижении РМБ, без влияния на СМБ (11, 54, 73). Например, Borsheim et al (15) обнаружили улучшение баланса мышечных белков при потреблении напитка, содержащего 100 г углеводов спустя 1 час после упражнений с отягощениями. Баланс оставался нулевым, но стал положительным только при оценке спустя 3 часа после приёма напитка. Таким образом, без увеличения доступности аминокислот лишь антипротеолитическое влияние инсулина недостаточно для начала накопления белков (положительного баланса белка) после упражнений с отягощениями.
Согласно некоторым данным, потери мышечной массы, которые обычно связывают с процессом старения, относительно не чувствительны к стимулированному инсулином поглощению аминокислот и стимуляции СМБ (118). Принимая во внимание данные Greenhaff et al (41), показывающие диссоциацию между инсулином и его эффектами или их отсутствием, мы полагаем, что любое связанное с возрастом снижение действия инсулина и его посредничество при стимуляции аминокислотами СМБ, вероятно, не обусловлено прямым действием инсулина на кинетику белка (42, 82). Вместо этого, по нашим предположениям, инсулин опосредует изменения кровотока в мелких сосудах (117), который может нарушаться у пожилых людей (99). Таким образом эффекты проявляется в относительно меньшей доставке аминокислот к мышцам при старении, что и приводит к нарушению ответного белкового синтеза.
Аэробные упражнения и общие изменения обмена мышечных белков
Влияние упражнений на выносливость и обмен мышечных белков изучено относительно недостаточно. По-видимому, это связано с общим мнением, что подобные упражнения обычно не приводят к существенному увеличения размеров мышц. Тем не менее, изменения СМБ после упражнений на выносливость достаточен для восстановления и ремоделирования тканей, а также для изменения синтеза белковых фракций, которые не участвуют в гипертрофии мышц, например, белков митохондрий. В настоящее время различие видов и интенсивности упражнений затрудняет текущее понимание влияния аэробных упражнений на СМБ и ограничивает нашу способность сравнивать исследования (18, 66, 72, 112).
Первые эксперименты, оценивающие срочную реакцию СМБ на ходьбу по беговой дорожке при 40% от максимального потребления кислорода у нетренированных людей, установили, что упражнения с низкой нагрузкой способны стимулировать увеличение СМБ (18, 97). Тем не менее, Tipton et al (112) отметили неспособность тренировки по плаванию высокой интенсивности стимулировать значительный ответный СМБ у тренированных пловчих. Подобные противоречия в результатах могут быть связаны с изучаемыми мышцами (латеральная широкая или дельтовидная), видом упражнений или уровнем тренированности спортсменов. Разумеется, последний фактор оказывает значительное влияние на результаты, так как было показано, что долговременная аэробная тренировка приводит к повышению базального уровня СМБ (88, 98).
Применение уникальной модели упражнений на выносливость - удары одной ногой на модифицированном эргометре Krog - стимулировало синтез белков саркоплазмы и миофибрилл в течение 48 и 72 часов, соответственно (72). Тем не менее, упражнения на выносливость обычно не связывают с гипертрофией скелетных мышц, что следует ожидать при таком существенном повышении синтеза белков миофибрилл. Поэтому «аэробные» упражнения одной ногой, видимо правильнее называть упражнениями с отягощениями низкой интенсивности. В нашей лаборатории недавно оценивали специфическую реакцию отдельных белков (миофибрилл и митохондрий), находящихся в скелетных мышцах, после велоэргометрии одной ногой в течение 45 минут при 75% от максимального потребления кислорода в тренированном и нетренированном состоянии. Независимо от уровня тренированности, мы наблюдали значительное увеличение синтеза белков митохондрий. При этом не отмечалось увеличение синтеза белков миофибрилл (123). Таким образом, белки митохондрий и в некоторой степени саркоплазматические белки являются основными белками, способствующими увеличению смешанного СМБ после упражнений на выносливость.
Реакция сигнальных процессов в клетке на тренировку и питание
Быстрое увеличение синтеза мышечных белков после тренировки и повышения доступности аминокислот подтверждает, что эти изменения опосредованы постранскрипционными механизмами (19). Тренировки и аминокислоты способны активировать синтез мышечных белков через отдельные, но сходящиеся сигнальные пути, с максимальной стимуляцией инициации трансляции и синтеза белков, требующей базальных уровней инсулина. Несмотря на то, что подробная оценка контроля транскрипции выходит за рамки данного обзора (6, 10, 28, 49), мы кратко обсудим ключевые регуляторные этапы сигнальных путей, в ответ на упражнения с отягощениями и питание. Заслуживает внимания недавно выявленная диссоциация между активацией сигнальных молекул и изменениями СМБ (41). Мы полагаем, что в случае адекватности стимула несколько сигнальных молекул (например, мишень рапамицина млекопитающих (mTOR)) реагируют на тренировку и аминокислоты почти максимально; в результате скоординированно увеличивается СМБ. Тем не менее, в связи с разрешающей, а не модулирующей ролью инсулина в отношении СМБ (41, 93), мы считаем, что значительное повышение инсулина усиливает активацию анаболических сигнальных молекул (предположительно, отражается в фосфорилировании), без дополнительного повышения СМБ (Рис. 4).
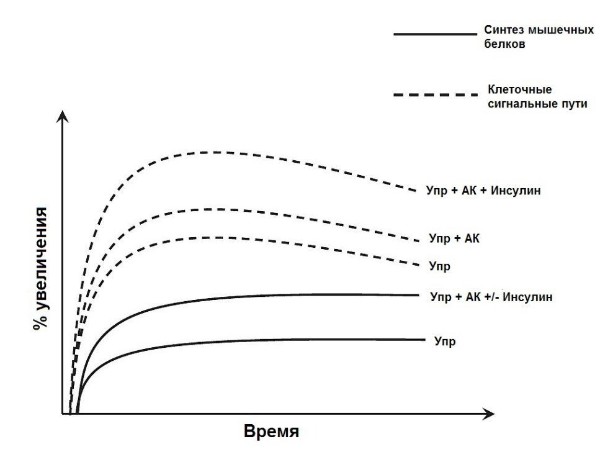
Рис. 4. Модель, показывающая как упражнения (Упр) и аминокислоты (АК) активируют анаболические сигнальные пути, инициирующие ответный СМБ. После достижения максимальной реакции дополнительное увеличение активации анаболических сигнальных белков (преимущественно через фосфорилирование) вероятно опосредуется инсулином, но не ведёт к дополнительному увеличению СМБ.
Клеточные сигнальные пути при тренировке с отягощениями
До сих пор не выяснен точный механизм, ответственный за передачу сократительных сигналов от цитоскелета клетки к аппарату белкового синтеза. Согласно данным исследований грызунов (31, 32, 40) и клеточных культур (126), киназа фокальной адгезии (FAK) – белок чувствительный к нагрузке, потенциальное звено в механотрансдукции нагрузочных стимулов к стимуляции СМБ. Недавно было показано, что фосфорилирование FAK не изменяется в течение 6 часов после однократной тренировки с отягощениями (38). Предполагают, что фосфорилирование FAK кратковременно и происходит непосредственно после нагрузки или в ответ на хроническую разгрузку (38). Это мнение поддерживается значительно большим фосфорилированием FAK у людей после 10 недель тренировки на выносливость или с отягощением, чем до тренировок, что подразумевает необходимость хронического стимула (123).
В настоящее время начинают постепенно прояснятся клеточные механизмы, находящиеся под сарколеммой, инициирующие ответный белковый синтез (7, 90). Так, основные посредники активации, такие как протеинкиназа В (Akt), mTOR и его эффекторы, 4Е связывающий белок (4E-BP1), протеинкиназа 70-кДа S6 (p70S6K) и рибосомный белок S6 (rpS6) проявили активность в срочный промежуточный (1 – 4 ч) период после тренировки (21, 26, 29, 46, 56, 125). Ответная реакция ожидается из-за того, что активация необходима для инициации реакции белкового синтеза. Однако о степени активации в более поздний период после однократной нагрузки известно мало. Согласно последним данным из нашей лаборатории, спустя 6 часов после упражнений с отягощениями натощак, mTOR уже фосфорилирован недостаточно; тем не менее, в нижележащих эффекторах p70S6K сохраняется значительная активность (38).
Ещё одной недостаточно исследованной переменной является влияние долговременной тренировки с отягощениями на клеточные сигнальные пути. Установлено, что тренировка может влиять на объём синтеза отдельных классов мышечных белков (миофибрилл и митохондрий) (123). Поэтому можно ожидать изменение активности ключевых инициирующих белковых факторов/киназ, контролирующих эти реакции. Недавно было показано увеличение фосфорилировании в покое Akt, фактора инициации эукариот 4E (elF4E), FAK и киназы гликогенсинтазы (GSK-) после 10-недельной тренировки с отягощениями. Кроме того, продолжительность активации уменьшалась по сравнению с нетренированным состоянием (123). Согласно имеющимся данным, 10-недельная тренировка модифицирует активированное состояние анаболических сигнальных молекул таким образом, что они легче реагируют инициацией синтеза белка в ответ на тренировочные стимулы. Тем не менее, в ответ на долговременную тренировку (8 – 9 лет) в определённом направлении (с отягощениями или на выносливость) анаболические сигналы могут подавляться (21). Это согласуется с идеей адаптивности тренировочного процесса и необходимостью повышать тренировочную нагрузку для достижения большего эффекта от занятий (принцип перегрузки) (58).
Клеточные сигнальные пути при тренировке на выносливость
Подобно упражнениям с отягощениями, тренировка на выносливость активирует белки, вовлечённые в регулирование СМБ (например, mTOR) (69). Тем не менее, одной из наиболее заметных адаптаций к тренировке на выносливость является увеличение аэробных способностей скелетных мышц, которое преимущественно обусловлена увеличением содержания митохондрий. Таким образом, изменения белкового синтеза митохондриальных (а не миофибриллярных) белков представляют особый интерес при изучении упражнений на выносливость. Одним из направлений, привлекающих особое внимание, является сигнальный каскад АМФ-активируемая протеинкиназа (AMPK) – 1-альфа-коактиватор гамма-рецептора, активируемого пролифераторами пероксисом (PGC-1α) и его роль в биогенезе митохондрий. Срочные упражнения на выносливость увеличивают транскрипцию и содержание иРНК PGC-1α, и этот эффект дополнительно усиливается при тренировке (89).
Клеточные сигнальные пути и питание
При оценке регуляции белкового синтеза питанием, основными эффекторами являются гормон инсулин и аминокислоты. Инсулин без повышения уровня аминокислот не стимулирует СМБ (41). Тем не менее, сигналы от инсулина проходят через несколько внутриклеточных путей, вовлечённых в инициацию трансляции и синтез белков, следовательно, принимают участие в модуляции этих клеточных реакций. Связывание инсулина с рецептором активирует PI3K, которая инициирует сигнальный каскад через Akt/протеинкиназу В (РКВ). Как упоминалось выше, Akt/РКВ фосфорилирует mTOR, который через эффекторы p70S6k1, а также 4Е-ВР1, приводит в конце концов к запуску трансляции и увеличению синтеза белка.
Аминокислоты также стимулируют несколько белков, участвующих в инициации трансляции, включая mTOR (22), p70S6k1 (22, 64), а также 4Е-ВР1 (65). Тем не менее, аминокислоты не активируют PI3K или Akt/PKB, а значит, стимуляция аминокислотами mTOR должна проходить через другие, не инсулиновые, вышележащие пути. Первоначально считали, что активация mTOR аминокислотами опосредована белками: комплексом туберозного склероза (TSC1/2), G-белок подобными β-субъединицами (GβL), регуляторным белком, связанным с mTOR (Raptor) или гомологом Ras, витаминизирующий мозг (Rheb) (9). Однако, согласно последним данным, аминокислоты стимулируют mTOR через PI3K 3 класса, человеческий вакуолярный сортирующий белок 34 (hVps34) (16, 78).
Половые различия белкового обмена
Половые различия метаболизма белка в сравнении с обменом жиров или углеводов невелики (96, 106). Однако немногочисленные исследования, сравнивающие мужчин и женщин, показали в общем, что женщины в меньшей степени используют белок в качестве субстрата при аэробных упражнениях, чем сопоставимые коллеги-мужчины (61, 62, 83). Также, согласно имеющимся данным, кинетика белка относительно мало меняется в течение менструального цикла, показывая, что срочные различия эстрогена и прогестерона, по-видимому, не столь сильно влияют на обмен белка в организме или мышцах (70). Кроме того, в базальном состоянии, по крайней мере, если кинетика нормализована к сухой массе, мужчины и женщины идентичны по скорости обмена мышечного белка (36).
В ответ на тренировки и питание молодые мужчины и женщины реагируют количественно и качественно сходным образом, так как в исследованиях, где испытуемыми были мужчины и женщины, половые различия оказались незначительными (26, 92, 114). Тем не менее, на сегодняшний день нам неизвестны исследования, оценивающие реакцию на питание и тренировки отдельно и в сочетании, в которых бы предпринимались систематические сравнения между мужчинами и женщинами. Однако при оценке данных о долговременной адаптации к тренировкам с отягощениями у мужчин и женщин результаты исследований говорят, что, несмотря на имеющиеся количественные различия в гипертрофии и приросте мышц, относительные изменения аналогичны (1, 45, 57). Таким образом, молодые женщины способны увеличить мышцы в результате тренировки с отягощениями (103, 120), несмотря на 10-кратное различие с мужчинами в концентрации тестостерона. Эти наблюдения согласуются с мнением о доминировании локального механизма увеличения СМБ и мышечной массы над системным, обусловленным концентрацией андрогенов в кровообращении.
Согласно немногочисленным данным, сухожилия у женщин потенциально хуже адаптируются к физическим упражнениям (71, 122). Примечательно, что эта пониженная способность к адаптации сухожилий может усугубляться от приёма оральных контрацептивов (42). Принимая во внимание большее количество травм связок и сухожилий у женщин по сравнению с мужчинами, данная область определённо является предметом исследований половых различий.
Несмотря на небольшие различия в обмене белка у молодых женщин и мужчин, для пожилых людей ситуация меняется: обнаружены различия базального СМБ (101). Возможно важнее, что пожилые женщины также оказались неспособными увеличивать СМБ в ответ на приём белка (101). У пожилых женщин понижена способность увеличивать мышцы от тренировки с отягощениями (2, 15, 57). Последние неопубликованные данные подтверждают гипотезу о нарушенной возможности гипертрофии у пожилых женщин, а также показывают меньшее увеличение СМБ после тренировки с отягощениями по сравнению с мужчинами (100). Причиной подобных изменения может быть пониженная способность и отзывчивость к анаболическим сигналам (37, 80, 101); тем не менее для окончательных выводов необходимо больше исследований взаимодействия возраста, пола и анаболизма, а также их связи с питанием и тренировкой с отягощениями.
Значение и перспективы
За последние несколько лет наше общее понимание регуляции обмена мышечных белков при тренировках и восстановлении стало более определённым. Всё очевиднее, что ответный СМБ строго регулируется и на размеры реакции можно влиять изменением множества факторов, связанных с самой тренировкой, а также с питанием. Существуют половые различия в обмене белков, связанные с тренировкой, но эти различия относительно невелики. В отличие от этого, у пожилых женщин по неизвестным причинам может развиться анаболическая резистентность к питанию и тренировкам. Понимание реакций отдельных субфракций мышечных белков (миофибриллярной, митохондриальной и саркоплазматической) и будущего отдельных белков прояснит различные изменения, вызванные тренировкой, и способы, посредством которых происходят различные адаптации мышц и в конечном итоге физиологические изменения, связанные с пластичностью скелетных мышц.
Тем не менее, существуют некоторые пробелы в исследованиях, которые не позволяют полностью понять регуляцию обмена белков после тренировки, а значит, необходимы дальнейшие исследования. Например, у людей наблюдается диссоциация между сигнальными белками, регулирующими инициацию белкового синтеза, и скоростью синтеза белка при непосредственном измерении (41). По-видимому, изменения молекулярных сигналов, регулирующих СМБ после тренировки, происходят очень быстро. Поэтому необходимо установить детальные хронологические последовательности сигналов и реакции мышечных белков в период непосредственно после нагрузки. В настоящее время большинство результатов получены в отдельные временные точки после тренировки (3 – 5, 48, 85, 87, 115). Мы полагаем, что за увеличение СМБ в более позднем периоде (24 – 72 часа) отвечают различные механизмы (72, 82), которые нужны для ремоделирования мышц и успешной адаптации к тренировочным стимулам. Следовательно, требуется провести эксперименты, оценивающие белковый обмен в период, начинающийся после срочного постнагрузочного (первые 1 – 4 часа), но меньший по продолжительности, чем долговременная адаптация к тренировке. В общем и целом, следует обратить внимание на то, что большинство исследований, оценивающих обмен белка в мышцах, выполнены в строго контролируемых условиях, помогающих выделить специфические механистические реакции на различные воздействия, а значит, неприменимы непосредственно к свободно живущим людям. В исследованиях зачастую используют модели, не назначаемые/не используемые в повседневной жизни. Тем не менее, эти исследования дают необходимую научную основу для диетологических и тренировочных вмешательств, которые впоследствии можно назначать различным группам населения в более «реальном мире». И наконец, хотя это и не основная регулируемая переменная, изменение распада мышечных белков после тренировки (особенно в период 24 – 72 часа), изучено недостаточно. Недостатки методологии при измерении скорости распада фракций, непосредственного измерения распада мышечных белков в скелетных мышцах в значительной степени ограничивают их использование в сытом состоянии и тем самым мешают полностью понять обмен белка в мышцах после физических нагрузок.
Источник: http://jap.physiology.org/