Синтез и распад белка в скелетных мышцах человека во время и после упражнений

Авторы: Vinod Kumar, Philip Atherton, Kenneth Smith, Michael J. Rennie.
Перевод - Сергей Струков.
Скелетные мышцы демонстрируют удивительную пластичность в ответ на изменения типа, продолжительности и интенсивности нагрузки, которые могут вызвать гипертрофию или атрофию, ограниченную гиперплазию и дифференциальную экспрессию множества белков и даже целых органелл, таких как митохондрии, с результирующими изменениями метаболизма субстратов и белков. С целью лучшего описания упражнения традиционно подразделяются на «аэробные / на выносливость» и «с отягощением (силовые)». Основное видимое отличие упражнений на выносливость (то есть повторяющихся низкоинтенсивных сокращений, которые могут выполняться продолжительное время) – смещение фенотипа в сторону возрастания количества волокон с более высокими окислительными способностями, в то время как повторные упражнения с отягощением (представляющие собой сокращения высокой интенсивности) вызывают гипертрофию волокон (и, вероятно, некоторую гиперплазию вследствие активации клеток-сателлитов). В реальности присутствует существенное «перекрытие» между вариантами ответов, это происходит вследствие восприятия и распределения мышцей сигналов в ответ на активность, которые приводят к постоянной адаптации к специфичной природе, интенсивности и продолжительности упражнений. В предлагаемом обзоре упражнения будут разделяться на «резистивные» (с дополнительным отягощением) и «нерезистивные» (без отягощения)…
…Целью обзора является описание регуляции обмена мышечных белков у человека во время и после упражнения, влияния на него факторов окружающей среды, таких как тип нутриентов, состав и уровень потребления, а также полового диморфизма и возраста. В обзоре представлены следующие темы:
- методики изучения обмена в мышцах человека;
- упражнения и общий мышечный белковый баланс;
- синтез мышечного протеина (СМП) и упражнения с отягощением (во время и после упражнения);
- СМП в упражнениях без отягощения (во время и после);
- распад мышечного протеина (РМП) и упражнения (во время и после упражнений с отягощениями и без них);
- влияние пищи (и синергия с упражнениями) на обмен мышечных белков;
- влияние продолжительной тренировки на метаболизм мышечных белков;
- пол и упражнения;
- старение и упражнения.
Мы включили в обзор три таблицы, в которых суммированы наиболее исчерпывающие исследования в данной области, проведенные в последние два-три десятилетия, освещающие специфичные переменные: возраст и пол, тип выполняемых упражнений, нутрициональные манипуляции, а также изменения в синтезе и распаде белков, позволяющие читателю ознакомиться с работами в данной области. Мы также включили рисунок, схематически отображающий основные клеточные сигнальные пути, вовлеченные в регуляцию синтеза мышечного белка в ответ на упражнения и прием пищи, – так, где возможно, мы кратко опишем связанные с этим изменения активности регуляторных путей как итог изменений их статуса фосфорилирования.
Мы ограничимся явлениями, происходящими в течение минут и часов (реже дней, исключительно для эффектов тренировки) во время или после упражнения. Изменения во время упражнения отражают активацию метаболических приоритетов в направлении переноса энергии для мышечной работы при множественных изменениях, таких как ингибирование синтеза белка, увеличение трансаминирования и окисления аминокислот – скорее сопровождающее явление, нежели специфическая функциональная адаптация в ответ на упражнения. Изменения в обмене мышечного белка в период после упражнений больше отражает приспособительное ремоделирование (например, увеличение синтеза группы миофибриллярных протеинов, ведущей к гипертрофии). Мы не будем обсуждать изменения в уровнях транскрипции генов.
Упражнения и общий баланс белка в мышцах
Мышечная масса поддерживается путем регулирования баланса между СМП и РМП. Общее увеличение мышечной массы возможно только в случае, если СМП превышает РМП, то есть при положительном белковом балансе, и наоборот. Во время отдыха в состоянии голода (правильнее называть постабсорбтивное состояние) общий баланс белка отрицательный, а позитивный баланс обычно наблюдается только, когда во время еды восполняются потери мышечного белка, поддерживая стабильную массу мышц. После упражнений в состоянии голода, независимо от увеличения СМП (см. ниже), общий баланс белка становится даже более негативным, не достигая положительных величин, так как уровень РМП, повышенный перед упражнениями, также повышается (13). Тем не менее, когда протеин или аминокислоты потребляются после тренировки, общий баланс белка становится положительным, так как СМП подавляет РМП, который может быть пониженным сам по себе (111).
СМП и упражнения с отягощениями
Во время упражнений

Измерения СМП человека, сделанные во время выполнения упражнений с отягощениями, редки, так как большинство исследований применяют тренировку короче минимального периода времени (около часа), которое требуется современным методикам для оценки проявления строгих изменений меченных стабильных изотопов. Также упражнения прерывистые, используются подходы повторяющихся сокращений, разделенные периодами отдыха, при которых мышца не пребывает в состоянии покоя, что усложняет интерпретацию полученных данных, особенно при методе, основанном на A-V пробах и кровотоке. Данные исследований мышц грызунов (24) и людей (37, 43) показывают угнетение СМП во время упражнений с отягощением. В то же время в работах, использовавших метод растворенных A-V меток, не увеличивался уровень поглощения меток, то есть синтез белка в мышцах ног не изменялся (39). Противоречие между ранними исследованиями (37) и более поздними данными (39), возможно, вызвано методологическими различиями (использование метода прямого включения против метода растворенных меток A-V) или является результатом различий в объеме выполненной работы. Обнаруженное резкое понижение СМП вызвано сокращением этапов инициации и элонгации при трансляции мРНК (63) из-за уменьшения фосфорилирования связывающего белка 4Е 1 (4ЕВР-1), эффектора, запускаемого мишенью рапамицина млекопитающих (mTOR), и тенденции к увеличению фосфорилирования фактора элонгации эукариотов 2 (eEF2) – отрицательного регулятора элонгации пептидной цепи (37) (рис. 1).
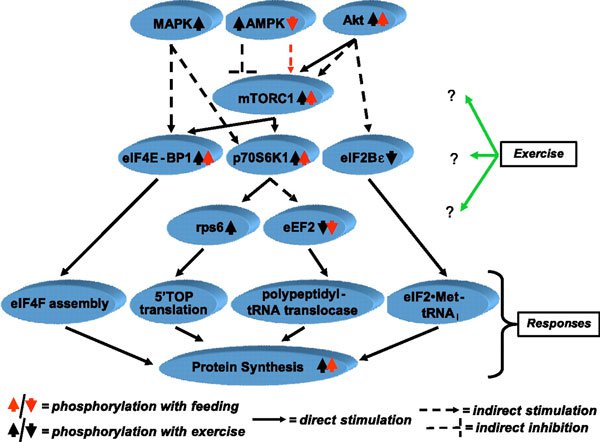
Рис. 1. МАРК – митогенактивированная протеинкиназа; АМРК – АМФ-активированная протеинкиназа; Akt – протеинкиназа В; mTORC1 – мишень рапамицина млекопитающих С1; eIF4E-BP1, eIF2Bε, eIF4F и eIF2: белок, связывающий фактор инициации эукариотов 4Е, 2Bε, 4Fb 2; p70S6K1 – 70-кДа S6 протеинкиназа 1; rps6 – рибосомный протеин s6; eEF2 – фактор элонгации эукариот 2; 5'TOP, 5-терминальный олигопиримидин; tRNAi – инициатор тРНК.
Bylund-Fellenius и коллеги (24) наблюдали вызванные сокращением понижение СМП в перфузированной электростимулированной мышце крысы, активность АТФ миозина вызвала повышение коэффициента АМФ/АТФ, вследствие чего, вероятно, оказывается стимулирующее воздействие на активность АМФ-активированной протеинкиназы (АМРК) (52), что вызывает ингибирование сигнальных эффектов комплекса туберозного склероза 2 на mTOR и уменьшает фосфорилирование 4ЕВР-1 (18). Активность АМРК действительно повышается на >30 % после выполнения упражнений с отягощением (37), но важность ингибирования mTOR при выполнении упражнений не определена, так, синтез белка повышается после выполнения упражнений независимо от продолжающегося повышения фосфорилирования АМРК (37).
Недавние работы также продемонстрировали эффективность предварительного потребления аминокислот на СМП во время упражнения. После ночного голодания испытуемые приняли 0,35 г/кг сухой массы тела незаменимых аминокислот и 0,5 г/кг сухой массы тела сахарозы за час до упражнений (10 х 10, 70 % РМ). СМП понизился во время выполнения упражнений, но не ниже исходного уровня, наблюдаемого в контрольной, не потреблявшей добавок группе (43). Подобным образом прием белка перед и во время 2-часовой прерывающейся тренировки с отягощениями, включающей упражнения для всего тела, повышал общий белковый баланс и СМП во время выполнения упражнений (7).
После упражнений
Общепринято, что упражнения с отягощениями вызывают увеличение СМП в восстановительном периоде (29, 71, 131). Действительно, тренировка с отягощением может увеличивать уровень СМП после упражнений в 2–5 раз, и этот эффект наблюдается более 48 часов у сытых субъектов (85). В других сообщениях (37, 100) обнаруживали угнетение СМП непосредственно после напряженной сократительной активности. В нашей лаборатории обычно наблюдаемые изменения не превышали исходные при оценке включения меток в белки первые 1–1,5 часа (66), тогда как другие этого не делали (37, 100), тем не менее большинство оценивающих исследователей свидетельствуют, что любое повышение после упражнения меньше вначале и увеличивается впоследствии (38, 66). Стимуляция синтеза белка у нетренированных людей после упражнений с отягощениями происходит в митохондриальном и миофибриллярном пулах (123). Более того, мы недавно исследовали влияние тренировки с отягощением на СМП в широком диапазоне интенсивности упражнений: от 20 до 90 % РМ при эквивалентной общей работе (1620–1800 единиц) в постабсорбтивном состоянии у молодых (24 ± 6 лет) и пожилых (70 ± 5 лет) мужчин в течение 4 часов после окончания занятия (66). Результаты показывают, что величина синтеза миофибриллярных белков зависит от интенсивности, увеличиваясь от 20 %, и достигает плато между 60 и 90 % РМ. Требуются дополнительные исследования для выяснения влияния объема работы и адаптивного ответа обмена мышечного белка при различной интенсивности нагрузки.
Молекулярный механизм стимулирующего эффекта упражнений с отягощением интенсивно изучался в последние годы – сначала на грызунах (2, 4, 19), а когда усовершенствовалась аналитическая техника – на человеческих мышцах (1, 34, 36, 37, 61, 66). Доступные в настоящее время данные, наиболее точно описывающие сигнальные пути во время и непосредственно после упражнений в состоянии голода и насыщения, представлены на рис. 1. Детальное описание активации процессов фосфорилирования или активности сигнальных молекул, регулирующих клеточный СМП в ответ на упражнения с отягощением, выходит за рамки настоящего обзора. Вкратце активация сигнальных молекул, регулирующих трансляцию и синтез белка, таких как Akt (протеинкиназа В), митогенактивируемая протеинкиназа, mTOR и его эффекторы, такие как эукариотический фактор инициации 4EBP-1, p70S6k1 (70-кДа протеинкиназаS6) и рибосомная протеинкиназа s6, связаны с увеличением СМП в период после упражнения (1, 36, 37. 61, 66). Тем не менее, необходимо выяснить временную зависимость и продолжительность этих ответов, а также дозозависимые характеристики, как и потенциальную роль в адаптивном ответе мышц на однократные и хронические упражнения.
В отношении клеточных сигнальных путей мы полагаем, что в настоящее время у нас нет точного понимания связи между изменениями в сигналах и СМП или РМП. В частности, непонятно, действует ли молекула как простой переключатель сигнального пути или как усилитель, модулирующий результирующую метаболическую реакцию. Данные исследований действия инсулина на мышцы человека слишком упрощенны, чтобы объяснить отдельные физиологические влияния на синтез или распад белка путем воздействия на степень фосфорилирования рассматриваемых молекул (50). Эту информацию можно более элегантно отобразить на основе данных зависимости от дозы и времени, собранных в нашей лаборатории (16, 17, 66).
СМП и упражнения без отягощения
Во время упражнений

Вероятно, во время бега СМП у грызунов понижается (35). Более поздние исследования зафиксировали уменьшение СМП на 26 % у крыс во время 2-часового бега на тредмилле (46). В основе изменений СМП во время 30-минутного бега мышей на тредмилле, возможно, лежит повышение активности АМРК и подавление общего уровня трансляции мРНК, а также сигнального пути mTOR (125). У людей общий уровень синтеза белка понижался во время ходьбы в гору при 40 % максимального потребления кислорода (VO2max) (93), и подобные изменения наблюдаются во время 2-часовой ходьбы при 60 % VO2max (22). СМП является значительной частью общего синтеза белка организмом, также известно, что отношение АДФ к АТФ значительно уменьшается при упражнениях без отягощения (24), на этом основании можно сделать вывод: во время ходьбы или бега у людей понижается СМП, но практически нет данных, подтверждающих это. Фактически во время ходьбы на тредмилле при 40 % VO2max (27) нет существенных изменений в СМП сравнительно с уровнем во время отдыха, тем не менее исходный уровень мог быть необычно низким по отношению ко дню без тренировки, что, вероятно, привело к ложно негативным выводам. Также, возможно, выбран недостаточный уровень интенсивности упражнений: велоэргометрия в течение часа при 70 % VO2max, выполняемая молодыми здоровыми субъектами, приводила к активации мышечной АМРК-α2 (42), измеренной в квадрицепсе с помощью биопсии непосредственно после упражнения; в подобном исследовании продолжительностью 90 минут отмечена значительная, вызванная Са2+ активация кальмодулинзависимой протеинкиназы еЕF2 киназы, совместно (и, возможно, как результат) с ингибированием активности еЕF2 и (в итоге) удлинение белковой цепи у здоровых мужчин в постабсорбтивном состоянии (97). Эти результаты противоречат гипотезе о снижении СМП во время езды на велосипеде и бега, тем не менее технически сложно организовать исследование, в котором у субъектов, упражняющихся продолжительное время и со значительной нагрузкой, можно удовлетворительно отследить обмен белка во время упражнения, но это возможно. Задача ожидает своего решения.
После упражнений
После ходьбы на тредмилле при 40 % VO2max в постабсорбтивном состоянии СМП в различных мышцах увеличивался на 45 % (26); о подобных изменениях сообщал и Sheffield-Mooreetal (101). Еще большее увеличение уровня синтеза миофибриллярной фракции могут вызывать более интенсивные упражнения у сытых молодых мужчин, 1 час маховых упражнений ногами ̴̴ 70 % РМ удвоили уровень синтеза миофибриллярного белка в квадрицепсе на 24 часа, синтез оставался повышенным еще более 72 часов (76).
Эти результаты можно было бы считать случайностью, так как обычно упражнения этого типа (которые скорее увеличивают биогенез митохондрий) не вызывают гипертрофию и, следовательно, не стимулируют синтез миофибриллярных белков, но накопившиеся данные развеивают сомнения. Описанные нами факты обнаружены у нетренированных субъектов, в этом случае и отягощения, и велоэргометрия стимулируют синтез белков и миофибрилл и митохондрий, возможно, в результате общего анаболического сигнала после упражнений, в то же время у тренированных не повышается синтез миофибрилл после велоэргометрии и не наблюдается синтез митохондриальных белков после однократной тренировки с отягощениями (123).
Степень изменений СМП в ответ на упражнения, вероятно, зависит от того, производится или нет существенная «ударная» сила, например, после интенсивного плавания СМП у здоровых людей существенно не изменяется (113). Тем не менее, важно отметить, что измерения проводились после длительной тренировки, выполненной натощак. Кроме того, испытуемые были хорошо тренированы, а долговременная тренировка увеличивает базальный уровень СМП и уменьшает СМП в ответ на однократное воздействие упражнений (86, 87, 102).
В настоящее время существует много описаний активирующих фосфорилирование сигналов, которые могут лежать в основе изменений СМП после однократного выполнения упражнений без отягощения, а также изменений СМП самого по себе (например, увеличение сигналов mTOR, уменьшение еEF2, митогенактивирующей протеинкиназы и т. д.) (1, 11, 74, 98). Количественно наблюдаемые изменения сходны с происходящими в ответ на упражнения с отягощениями, и действительно, различия в ответ на однократные упражнения, при которых мышцы ног работают в разных режимах, «силовом» и «на выносливость», незначительны у тех же нетренированных людей (123). Это означает, что любое значительное увеличение сократительной активности или возможности утилизации субстратов нетренированными мышцами ведет к сходному анаболическому ответу. Тем не менее после периода тренировки СМП становится более чувствительным к специфическому типу упражнений, вызывая синтез отдельных субклеточных белковых фракций (митохондриальной или миофибриллярной), впоследствии проявляясь в фенотипических изменениях, характерных для разных видов тренировки (123). Фенотипические изменения, вероятно, возникают в результате повторного выполнения каждого из видов упражнений с отягощениями или «динамических». В настоящее время существует ограниченное количество данных о влиянии тренировки на активацию фосфорилирования сигнальных белков, этого недостаточно для возможности предсказания влияния на обмен протеинов изменений фосфорилирования.
РМП и упражнения
Во время упражнений с отягощениями
Только метод, основанный на A-V растворенных меченых аминокислотах, обсуждаемый ранее, доступен в настоящее время, однако его точность в данном случае весьма сомнительна. Насколько нам известно, только в двух исследованиях отслеживали уровень растворения меток «во время» упражнения (в действительности – во время отдыха между подходами) в постабсорбтивном состоянии; в этих исследованиях наблюдаемый уровень фенилаланина, показателя распада белка, не повышался во время отдыха (39, 114). Возможно, это объясняется тем, что протеолиз в мышцах происходит преимущественно через АТФ-зависимую убиквитинпротеазную систему (3), отношение АДФ к АТФ увеличивается во время упражнений, что может быть причиной его (распада) подавления во время выполнения упражнений, как в случае синтеза белка (см. выше).
После упражнений с отягощениями
Какой бы ни была неопределенность для периода упражнений, несомненно, что в постабсорбтивном состоянии после упражнения протеолиз в мышцах увеличивается, как показано с помощью растворенных меток (13, 15) и методом оценки уровня фракционного распада (ФРУ) (65). Перед упражнениями мышцы имели отрицательный баланс аминокислот, и эта ситуация лишь немного улучшалась при выполнении интенсивных упражнений с отягощениями, потому что, в то время как СМП увеличивался вдвое, ФРУ, существенно больший, чем ФРУ в постабсорбтивном состоянии, также увеличивался на 30–50 % спустя 3 часа, таким образом поддерживался отрицательный баланс (13, 85, 86). Тем не менее повышение распада в мышцах меньше по времени, чем уровень фракционального синтеза (24 часа по сравнению с 48) (85).
РМП и упражнения без отягощения
Неясны изменения РМП во время упражнений без отягощения. Во множестве экспериментов с циклическими упражнениями отмечали увеличение высвобождения аминокислот из нижних конечностей (72, 73) и на основании этого делали вывод о повышении протеолиза. Тем не менее высвобождение аминокислот объясняется скорее ингибированием синтеза белка, что приводит к недостаточной компенсации распада, и в результате из аминокислотного пула высвобождаются свободные аминокислоты.
Не вызывает сомнений, что в постабсорбтивном состоянии после упражнений без отягощений (45 минут ходьбы на тредмилле при 40 % VO2max) протеолиз в скелетных мышцах повышается как у молодых, так и у пожилых мужчин. В нижних конечностях увеличение протеолиза наблюдается через 10 и исчезает через 60 минут, но только у молодых субъектов (101).
Противоположные результаты получены с помощью микродиализа: концентрация 3МеН в диализате не изменялась от 6 до 72 часов после маховых упражнений одной ногой в течение часа при ̴ 70 % РМ (55). Возможно, это объясняется тем, что протеолизу подвергались «немиофибриллярные» протеины, при этом 3МеН не образуется, но более вероятно, что этот метод вообще не подходит для оценки мышечного протеолиза (13, 85, 95).
Сигнальные пути и РМП
Сигнальные пути, контролирующие РМП и протеолиз в мышцах человека, не определены. Различные протеолитические пути (включая лизосомальный, активируемый кальцием и убиквитин-протеосомо-зависимую систему, каспазы и металлопротеазы, а также неспецифические ди- и трипептидазы) вовлечены в ремоделирование мышц вследствие упражнений, но долевое участие каждого из них непонятно.
Увеличение активности активируемых кальцием протеаз и металлопротеаз отмечено в мышцах крысы во время и после бега на тредмилле (9, 25). Существует ограниченное количество сообщений об измерениях острых изменений производительности или контроля путей мышечного протеолиза у людей. В мышцах грызунов обнаружены две мышечные убиквитинлигазы, F-box мышечной атрофии (MAFbx) и мышечный reallyinterestingnovelgene fingerprotein 1 (MuRF1), стимулирующие протеолиз (3). Исследования экспрессии протеолитических генов в мышцах молодых субъектов спустя 4 часа после упражнений с отягощением, особенно экспрессии генов убиквитинапротеосом, показали увеличение активности MARFbxи MuRF1мРНК, но без существенных изменений в forkheadbox 3AмРНК (91). Парадоксально, но эксперименты нашей группы обнаружили снижение активности MARFbxм РНК в первые 24 часа после упражнений с отягощениями, которое означало увеличение РМП в посттренировочном состоянии (65). Это может быть связано с объемом и видом упражнения, выполняемого в последнем исследовании, где испытуемые выполняли подъемы на ступеньку с дополнительным отягощением, составлявшим 25 % от их массы тела, до полного утомления, а также со временем измерения. С другой стороны, в нашей лаборатории ранее не обнаружено прямой зависимости между РМП и экспрессией MARFbx (50). В любом случае существует и активируется множество путей, тем не менее интересно представить, как интактные миофибриллярные белки могут «реконструироваться» или ремоделироваться таким образом, чтобы оставалось место для вновь созданных протеинов, которые, согласно нескольким исследованиям (101, 113), синтезируются в течение часов после стимуляции упражнением.
Влияние потребления пищи на СМП и упражнения
 Потребление смешанной пищи усиливает СМП вдвое (94), и этот эффект, судя по нашим данным, обусловлен преимущественно действием аминокислот (10, 106), особенно лейцина (106), без значительного вмешательства инсулина (16, 32). Аминокислоты увеличивают синтез миофибриллярных, саркоплазматических, а также митохондриальных белков в скелетных мышцах (17), вероятно, дозозависимым способом (16, 32).
Потребление смешанной пищи усиливает СМП вдвое (94), и этот эффект, судя по нашим данным, обусловлен преимущественно действием аминокислот (10, 106), особенно лейцина (106), без значительного вмешательства инсулина (16, 32). Аминокислоты увеличивают синтез миофибриллярных, саркоплазматических, а также митохондриальных белков в скелетных мышцах (17), вероятно, дозозависимым способом (16, 32).
Упражнение с отягощением и еда синергически повышают СМП и ведут к положительному белковому балансу после упражнения, большему, чем просто потребление пищи (14). Несколько групп отметили, что потребление аминокислот или протеина, совместно с углеводами или без них, после упражнений с отягощением (14, 21, 33, 64, 77, 79, 90, 108, 112) или без отягощений (76) дополнительно усиливали СМП. Например, увеличение СМП на 145 % по сравнению с исходным состоянием происходило, когда после упражнений потреблялись обогащенные лейцином незаменимые аминокислоты с углеводами, тогда как без действия нутриентов СМП увеличивался на 41 % (36). Усиливающий эффект потребления пищи после упражнений, видимо, вызван увеличением количества аминокислот, а не глюкозы в крови (20, 77).
Кривая дозозависимого увеличения СМП после упражнения и потребления белка (80) имеет сходную форму с наблюдаемой в покое (17) с небольшим сдвигом влево вверх под влиянием упражнений. Таким образом, работы показывают синергизм между едой и упражнением. Также не выявлено преимуществ при потреблении большого количества белка (>20 г, что на самом деле немного) с целью повышения накопления мышечного протеина, максимально эффективная доза составляет, вероятно, 15–20 г высококачественного белка: мясного, яичного или соевого.
Время потребления пищи
Нет единого мнения, что приводит к большему СМП: потребление аминокислот до или после упражнений. Так, сообщалось (114), что прием незаменимых аминокислот с углеводами непосредственно перед упражнениями с отягощениями вызвал большее поглощение аминокислот нижними конечностями, но эти результаты трудно проверить количественно, так как они получены не в состоянии покоя и увеличение потребления некорректно отражает размер физиологического повышения (в 20 раз), вероятно, имеет место артефакт – захват аминокислот из внутримышечного пула. Более того, недавно показано путем прямого измерения синтеза отдельных фракций у людей, что потребление пищи за 1 час до интенсивных упражнений с отягощениями не приводит к дополнительному повышению СМП в течение 2 часов после окончания нагрузки (43). Таким образом, в очередной раз показано, что метод растворенных меток предоставляет количественно и качественно различающиеся результаты по сравнению с «включением» меченых аминокислот.
В то время как остается невыясненным, когда лучше потреблять белок для максимального СМП в ответ на упражнения, существуют результаты непрямых измерений в отношении долговременной тренировки, таких как гипертрофия, показывающие, что у молодых и пожилых людей происходит большее увеличение мышечной силы и массы, если белок потребляется непосредственно после упражнений, чем через несколько часов (40, 53, 67).
Качество белка
Большой интерес представляет предположение, что белки различного «биологического качества» и усвояемости могут быть более или менее эффективны для обеспечения мышц аминокислотами после упражнений. Недавние работы Филлипса и коллег (53, 124) выявили преимущество сывороточного белка перед казеином, соевым протеином и белком цельного молока относительно общего включения в белки мышц. В то же время нет доказательств в пользу преимуществ молочного протеина в сравнении мясным, яичным или соевым (78).
Анаболические сигнальные пути
Молекулярный механизм, лежащий в основе увеличения стимулирующего СМП эффекта еды после упражнений, связан с большим повышением фосфорилирования mTOR, p70S6K1 и 4EBP-1, чем только при выполнении упражнений (рис. 1) (36, 61, 64).
Влияние упражнений и приема пищи на РМП
Аминокислоты сами по себе оказывают, по крайней мере небольшое (50), ингибирующее влияние на распад белка в нижних конечностях у человека, особенно в присутствии инсулина, но эффект меньший, чем наблюдающийся у животных. Подавление разрушения белка в мышцах предплечья человека происходит после введения смеси аминокислот с разветвленной боковой цепью (68, 69). Большинство физиологических эффектов аминокислот на РМП в покое, вероятно опосредовано повышением секреции инсулина. Тем не менее несколько исследователей сообщили, что увеличение биодоступности аминокислот после упражнений не ингибирует существенно РМП человека (14, 21, 70, 90, 112).
Влияние тренировки на метаболизм мышечного белка
Продолжительные упражнения с отягощениями увеличивают средний поперечник волокон и вызывают гипертрофию мышц. Тем не менее мы преимущественно игнорируем временную зависимость изменений и точный механизм происходящего, который должен включать активацию СМП и ремоделирования, а также разрушение «отработавших» белков и РМП. Несколько работ отметили, что тренировка с отягощением увеличивает базальный уровень СМП (5, 86). Также было показано, что даже кратковременная (2 недели) тренировка с отягощениями увеличивает СМП в покое, но данные сложно интерпретировать в связи с тем, что СМП измеряли кратковременно (между 3 и 18 часами) после последнего занятия, и увеличение СМП могло быть следствием срочного влияния упражнений, а не тренировки самой по себе (54, 129, 131). В подтверждение увеличения СМП в покое вследствие упражнений зафиксировано повышение фосфорилирования Akt-mTOR-p70S6k (123). Тем не менее есть противоположные данные, полученные в той же лаборатории, в отношении долговременной тренировки (109). Мы с коллегами оценивали срочный эффект упражнений (велоэргометрия) с отягощением и без него в разных нижних конечностях одних и тех же субъектов после 10 недель тренировки на синтез миофибриллярных и митохондриальных белков: в ноге, тренировавшейся с отягощением, отмечено повышение синтеза миофибриллярного белка в состоянии покоя, тогда как тренировка без отягощения увеличила только синтез митохондриального белка (123). Эти результаты указывают на то, что повторные специфические нагрузки увеличивают синтез отдельных белковых фракций не в результате кратковременной модуляции активности трансляции, а за счет активации специфических программ транскрипции генов (65, 91).
Также отмечалось ингибирование СМП после однократной тренировки в результате долговременных упражнений (86). Тем не менее в той же лаборатории недавно обнаружено ̴ 48 % увеличение СМП после одной тренировки в результате 12 недель долговременного выполнения занятий, включающих упражнения с отягощениями (62). Эти различия объясняются относительно низким стимулом в тренированном состоянии вследствие применения аналогичной абсолютной интенсивности перед и после тренировки в предыдущем исследовании (62). Однако мы с коллегами также зафиксировали понижение синтетического ответа (̴ 30 %) после однократного занятия в конечности, «тренировавшейся» с отягощением, при аналогичной относительной интенсивности (123).
Имеются свидетельства не только различий величины ответных изменений СМП, но и временные различия: долговременные упражнения с отягощениями вызывают более быстрое, но кратковременное повышение СМП, чем однократное занятие у нетренированных (109). Таким образом, тренировочный статус – важный параметр, когда оценивается ответ мышц на однократные упражнения.
Сообщалось об увеличении СМП в латеральной широкой мышце в покое на 22 % в результате 16 недель велоэргометрии без отягощения (45 минут при 80 % максимальной ЧСС, 3–4 дня в неделю) (102). Вероятно, умеренное повышение общего фракционного синтеза белка было результатом более высокого увеличения синтеза в митохондриальной и/или саркоплазматической фракции. Даже спустя 4 недели после программы ходьбы/бега при 65–85 % максимальной ЧСС отмечался умеренно повышенный общий фракционный синтез белка (~17 %); тем не менее, отмечается парадоксальное явление: увеличение общего фракционного синтеза белка (~40 %) приводит к более отрицательному белковому балансу (87).
Если упражнения без отягощения вызывают увеличение СМП, почему же тогда не происходит гипертрофии мышц? Увеличение СМП после динамических упражнений может быть, в частности, связано с повышением синтеза белков, которые ответственны за адаптационные изменения при этом виде упражнений, то есть за увеличение объема митохондрий, активность митохондриальных энзимов и синтез белка в митохондриях (48, 57). В поддержку этого Шорт с коллегами сообщили об увеличении синтеза белков, транспортирующих глюкозу, белков митохондрий, уровня митохондриальных энзимов и 22 % увеличении общего СМП в покое вследствие 16-недельной программы «аэробных» упражнений (102, 103). Недавно Wilkinson et al. (123) показали, что повторные динамические упражнения продолжительностью более 10 недель увеличивают только синтез митохондриальных белков и не оказывают влияния на синтез белков миофибрилл или на общее фосфорилирование Akt-mTOR-p70S6k у молодых здоровых людей. На уровне транскрипции «негипертрофические» упражнения (30 минут бега при 75 % VO2max) увеличивают относительное содержание мРНК и транскрипцию различных миогенных и метаболических генов (для миогенной дифференциации гексокиназы II и пируватдегидрогеназной киназы 4) после упражнения, которое достигает максимума через 4–8 часов и возвращается к исходному уровню через 24 часа (126). Кумулятивным эффектом этого преходящего увеличения вследствие повторной динамической тренировки является адаптация мышц, наблюдаемая при упражнениях без отягощения (31).
Адаптивные изменения к динамическим упражнениям проявляются в подавлении АМРК, внеклеточной, регулирующей сигналы киназы 1/2 и активности сигналов mTOR после 10 дней интенсивных велоэргометрических нагрузок: 45–60 мин при 75–90 % у здоровых людей (11). Увеличение экспрессии специфичных мышечных коактиваторов транскрипции, активирующего пролиферацию рецептор-ү коактиватора-1α пероксисом (PPAR-1α), также может быть связано с адаптивным ответом на динамические упражнения, приводящим к биогенезу митохондрий и увеличению окислительной способности (88, 89). Тем не менее физиологическая роль PPAR-1α в адаптивном ответе мышц на тренировку нуждается в подробном изучении.
Половые различия в метаболизме мышечных белков и упражнения
 К сожалению, мало что известно про влияние полового диморфизма на композицию тела, при этом мужчины имеют большую массу мышц, чем женщины. Хорошо известно анаболическое влияние тестостерона на мышцы (41, 58), и секреция тестостерона в пубертатном периоде, скорее всего, ответственна за увеличение массы мышц в раннем взрослом возрасте. Тестостерон также увеличивает СМП в покое как у молодых, так и у пожилых людей (23, 116), но это влияние не связано со срочными изменениями синтеза белка, а проявляется ген-зависимыми изменениями, через воздействие на андрогенные рецепторы ядра. Женские половые гормоны ингибируют СМП и рост мышц у крыс (115), но не выявлено измеримых различий между мужчинами и женщинами в базальном уровне фракционного белкового синтеза или ответе на внутривенное введение аминокислот при умеренном уровне инсулина (Smith G., Mittendorfer B., Atherton P. и Rennie M. J., неопубликованные данные). Также не выявлены различия СМП или РМП в исходном уровне или после упражнений между молодыми мужчинами и женщинами (44, 59, 75, 82).
К сожалению, мало что известно про влияние полового диморфизма на композицию тела, при этом мужчины имеют большую массу мышц, чем женщины. Хорошо известно анаболическое влияние тестостерона на мышцы (41, 58), и секреция тестостерона в пубертатном периоде, скорее всего, ответственна за увеличение массы мышц в раннем взрослом возрасте. Тестостерон также увеличивает СМП в покое как у молодых, так и у пожилых людей (23, 116), но это влияние не связано со срочными изменениями синтеза белка, а проявляется ген-зависимыми изменениями, через воздействие на андрогенные рецепторы ядра. Женские половые гормоны ингибируют СМП и рост мышц у крыс (115), но не выявлено измеримых различий между мужчинами и женщинами в базальном уровне фракционного белкового синтеза или ответе на внутривенное введение аминокислот при умеренном уровне инсулина (Smith G., Mittendorfer B., Atherton P. и Rennie M. J., неопубликованные данные). Также не выявлены различия СМП или РМП в исходном уровне или после упражнений между молодыми мужчинами и женщинами (44, 59, 75, 82).
Тем не менее, согласно нашим и другим сообщениям, у женщин после менопаузы исходный уровень СМП на ~20 – 30 % выше, чем у мужчин (56, 105), и незначительно реагирует на прием пищи (105), таким образом, различия в метаболизме белка проявляются с возрастом, вероятно, в результате изменения в гормональном статусе. Изменения возникают независимо от композиции тела, так, нами были обследованы субъекты с ожирением (ИМТ 36–38) (105), в отличие от эксперимента группы Nair's (56), сообщавшей об аналогичных различиях в базальном уровне СМП. Известно, что пожилые женщины демонстрируют меньшую гипертрофию (~33 %), чем мужчины, в ответ на тренировку с отягощением (3 дня в неделю, 26 недель) (6), вероятно, из-за неспособности поддерживать адаптивный ответ на хроническое тренирующее воздействие; так, пожилые мужчины увеличивают базальный уровень СМП на ~50 % после 3 месяцев тренировки, тогда как пожилые женщины только на ~15 % (104)
Влияние возраста на метаболизм мышечного белка и упражнения
 Противоречивы сведения относительно базального уровня СМП у пожилых людей, в некоторых ранних исследованиях сообщалось о снижении уровня синтеза белка в мышцах по сравнению с молодыми субъектами (96, 121, 127). Тем не менее, если данные корректны, величина утраты мышечной ткани с возрастом должна быть намного выше, чем обычно наблюдаемая, поэтому большинство ученых в настоящее время согласны, что у здоровых людей старение не влияет на базальный уровень СМП, и общий баланс белка у здоровых пожилых людей не снижается (32, 117, 119). Умеренное повышение двигательной активности предотвращает связанную с возрастом утрату мышечной силы, а также возрастную жировую инфильтрацию мышц у пожилых людей (40). Более того, было показано, что у пожилых людей СМП может стимулироваться как упражнениями с отягощением, так и питанием (32, 38, 131). Тем не менее мы недавно продемонстрировали «анаболическую резистентность» СМП стариков к однократной тренировке из упражнений с отягощениями в широком диапазоне интенсивности нагрузки – на ~30 % меньший ответ у пожилых в сравнении с молодыми людьми (66).
Противоречивы сведения относительно базального уровня СМП у пожилых людей, в некоторых ранних исследованиях сообщалось о снижении уровня синтеза белка в мышцах по сравнению с молодыми субъектами (96, 121, 127). Тем не менее, если данные корректны, величина утраты мышечной ткани с возрастом должна быть намного выше, чем обычно наблюдаемая, поэтому большинство ученых в настоящее время согласны, что у здоровых людей старение не влияет на базальный уровень СМП, и общий баланс белка у здоровых пожилых людей не снижается (32, 117, 119). Умеренное повышение двигательной активности предотвращает связанную с возрастом утрату мышечной силы, а также возрастную жировую инфильтрацию мышц у пожилых людей (40). Более того, было показано, что у пожилых людей СМП может стимулироваться как упражнениями с отягощением, так и питанием (32, 38, 131). Тем не менее мы недавно продемонстрировали «анаболическую резистентность» СМП стариков к однократной тренировке из упражнений с отягощениями в широком диапазоне интенсивности нагрузки – на ~30 % меньший ответ у пожилых в сравнении с молодыми людьми (66).
Тогда как другие исследователи сообщали о запаздывании ответной реакции на упражнения с отягощениями у пожилых людей (38), мы не обнаружили подобного эффекта (66). Эти расхождения могут быть вызваны меньшим объемом упражнений, использованных в эксперименте, и обстоятельством, что субъекты изучались в состоянии голода после ночного сна (66). Подобный «притупленный» анаболический эффект наблюдался у стариков в ответ на прием пищи, расцененный как снижение чувствительности и способности к анаболическому ответу на прием аминокислот отдельно (32) и в сочетании с глюкозой (118).
Худший анаболический ответ СМП на упражнения с отягощением в мышцах пожилых людей, видимо, связан со снижением активации восходящего сигнала пути mTOR и повышением активности АМРК по сравнению с мышцами молодых людей (38). В исследованиях на грызунах обнаружено снижение активации сигнального пути mTOR после упражнений с отягощениями и повышение активности АМРК у пожилых крыс по сравнению с молодыми животными (45, 83, 111).
Недостаточное количество данных об РМП в ответ на упражнения у стариков. Используя метод растворенных A-V меток, обнаружено некоторое увеличение распада белка в состоянии покоя у пожилых людей (119). Тем не менее, по нашим данным, нет различий в базальном РМП, но «нормальное» ингибирование РМП инсулином существенно ниже у стариков (122). Видимо, «притупленный анаболизм» – широко распространенное явление в стареющих мышцах.
Минимизация потерь мышечной ткани, поддержание массы и функций мышц – основная цель при старении; мы должны понять синергию между упражнениями и приемом пищи, а также разработать надлежащую стратегию тренировок и питания для пожилых людей.
Выводы
Подводя итог, можно констатировать, что мышцы показывают удивительную пластичность в ответ на упражнения. Во время упражнений с отягощениями и без них СМП подавляется, тогда как после тренировки – повышается как в голодном, так и в сытом состоянии. Эта стимуляция проявляет зависимость от дозы и величины воздействия; тем не менее, для выяснение роли рабочей нагрузки требуются дополнительные исследования. Независимо от различий в нагрузке и наличия (или отсутствия) отягощения, сократительная активность вызывает сходный срочный анаболический ответ в нетренированных мышцах. Однако после периода тренировок срочный ответ уменьшается и зависит от вида упражнений: с отягощением или без отягощения и стимулирует синтез белков миофибрилл (с отягощением) или митохондрий (без отягощения), вероятно, отражая адаптивные изменения в зависимости от вида упражнения. Активация РМП во время упражнения с отягощением или без остается невыясненной. Тем не менее существует достаточно данных, подтверждающих увеличение РМП после обоих видов упражнений. Общее увеличение мышечной массы (СМП – РМП) после упражнений проявляется только при повышении доступности аминокислот во время постнагрузочного периода. Приблизительно 20 г высококачественного белка, например молочного, достаточно для инициации максимального синтетического ответа и, соответственно, общего увеличения массы мышц.
С возрастом уменьшается синтез белка миофибрилл в ответ на упражнение и потребление пищи, последние данные свидетельствуют о существовании половых различий в обмене мышечного белка, особенно об уменьшении ответа на упражнения у пожилых женщин.
Активация АМРК в результате клеточных запасов энергии играет важную роль в ингибировании синтеза белка. Увеличение синтеза белка после упражнений опосредуется активацией передачи сигналов mTOR и последующих эффекторов. Связь времени и величины ответа между упражнениями и фосфорилированием регуляторов клеточных сигнальных путей, вовлеченных в синтез и деградацию белка, только начинает выясняться. Несмотря на то что эти процессы фосфорилирования в основном качественно проявляются в результате анаболических стимулов, таких как упражнения, требуется гораздо больше работ для расшифровки сигналов, которые их включают или выключают и в конечном счете контролируют адаптивный ответ, например, мышечную гипертрофию или биогенез митохондрий. Конечно, в настоящее время невозможно напрямую связать размеры активации обмена мышечных белков с фосфорилированием сигнальных молекул. Когда мы сможем сделать это, мы будем гораздо ближе к нашей цели – пониманию регуляции мышечной массы и функции и разработке стратегии максимизации поддержания мышц в здоровье и болезни.
Источник: https://journals.physiology.org/