Поддержание массы тела: физиологические основы набора веса после его снижения

Авторы: Priya Sumithran and Joseph Proietto.
Перевод - С. Струкова.
Несмотря на то, что снижения массы тела, как правило, можно достигнуть за счёт ограничения потребления пищи и/или увеличения физической активности, подавляюще большинство людей через некоторое время восстанавливают вес, который они потеряли. Результаты мета-анализа следующие. Спустя 4,5 года после завершения структурированной программы по снижению веса, включающей гипокалорийную диету с применением упражнений или без них, средняя потеря массы тела, которую удалось поддержать, составила 3 кг (3,2% снижения от исходного веса) (1). Количество людей, кто успешно поддерживает сниженный вес, варьируется в зависимости от определения «поддерживаемого веса» от менее 3% (100% снизивших вес во все контрольные визиты в течение 4 – 5 лет после завершения программы по снижению массы тела (2)) до 28% (поддерживающих потерю, по крайней мере, 10% исходного веса за 4 года (3)). Wing and Hill (4) предлагают использовать в качестве определения успешной потери веса «поддержание дольше 1 года не менее 10% потери веса от исходного. Согласно этому определению, 20,6% из 228 людей с лишним весом по результатам случайного набора телефонных номеров в США, сообщили об успешном поддержании веса (4). Почему же сниженный при помощи питания вес так трудно сохранять? Представленный обзор рассматривает данные исследований с участием людей. Он начинается с рассмотрения вопросов регулирования веса, чтобы создать основу для последующего обсуждения краткосрочных и долговременных физиологических изменений, которые сопровождают снижение массы тела с помощью диеты. Несколько подробных тематических обзоров по сходному вопросу на животных моделях ожирения были опубликованы ранее (5, 6).
Регулирование массы тела
Несмотря на значительные колебания потребления пищи изо дня в день, масса тела большинства взрослых людей остаётся относительно стабильной долгое время. Несмотря на то, что можно достигнуть существенных изменений веса у людей и животных при ограничениях или чрезмерном питании, когда ограничения снимаются, масса тела и ожирение возвращаются точно к исходному уровню (7, 8). Подобное гомеостатическое регулирование массы тела происходит преимущественно в гипоталамусе как результат интеграции периферический сигналов, передающих информацию о кратковременных приёмах пищи и долговременном балансе энергии. По-видимому, эта система защищает нас в большей степени от потери веса, чем от увеличения (9, 10), что явно выгодней для выживания в периоды, когда пищи не хватает, как это было на протяжении большей части эволюции человека и до сих пор имеет место во многих частях земного шара. Тем не менее, для людей с ожирением, которые живут в обстановке широкого доступа к еде, это означает, что достигнутое снижение веса будет чрезвычайно трудно поддерживать.
Гомеостатическое регулирование
Основным регионом мозга, ответственным за контроль гомеостаза потребления пищи являются дугообразные ядра гипоталамуса (ARC). В пределах ARC существуют разные, взаимодействующие между собой группы нейронов, с противоположным влиянием на энергетический баланс. Нейроны, секретирующие нейропептид Y (NPY), и агути-связанный пептид (AgRP) стимулируют потребление пищи, в то время, как нейроны, выделяющие проопиомеланокортин (POMC), вызывают противоположный эффект. Проекции ARC распространяются в другие регионы гипоталамуса, включая паравентрикулярные ядра (PVN), где выделяются тиротропин-высвобождающий гормон (TRH), кортикотропин-высвобождающий гормон (CRH) и окситоцин (подавляют голод), а также латеральный гипоталамус, являющийся источников меланин-концентрирующего гормона (MCH) и орексинов (вызывают голод).
Таблица 1
Гормоны и пептиды, участвующие в регуляции аппетита
| Локализация | Анорексигенные | Орексигенные |
|---|---|---|
| Центральные | ||
| Гипоталамус |
POMC (13) Несфатин-1 (15) TRH (17) CHR (19) Окситоцин (21) Серотонин (23) Гистамин (25) Урокортин (26) |
NPY (14) AgRP (16) Орексины/гипокретины (18) MCH (20) Эндоканнабиноиды (22) Опиоиды (24) |
| Периферические | ||
| Желудочно-кишечный тракт |
ССК (27) GLP-1 (29) PYY (30) Оксинтомодулин (31) Энтеростатин (32) Бомбезин (33) Урогуанилин (34) |
Грелин (28) |
| Поджелудочная железа |
Амилин (35) Инсулин (36) РР (37) |
|
| Жировые клетки | Лептин (38) | |
Периферические сигналы, отражающие краткосрочный и долговременный баланс энергии, двигаются к центру и влияют на относительную активность двух кругов ARC. Гормоны лептин (из жировой ткани) и инсулин (из поджелудочной железы) регулируют долговременный энергетический баланс, тогда как сигналы кратковременной регуляции поступают в мозг от одного приёма пищи до другого и включают гормоны желудочно-кишечного тракта и поджелудочной железы: грелин, холецистокинин (ССК), глюкагоноподобный пептид- 1 (GLP-1), амилин, панкреатический пептид (РР) и пептид YY (PYY), плюс многие, которые ещё предстоит описать (Таблица 1). Эта периферическая информация передаётся с кровотоком и посредством блуждающего нерва в гипоталамус и заднюю часть мозга (а также регионы ствола и ядро одиночного пути). Через эти регионы проходят реципрокные пути, позволяющие интегрировать сигналы, регулирующие потребление пищи и расход энергии (рисунок 1.) (12). Регуляция гомеостаза поддержания массы тела обсуждается подробней в другом месте (11).
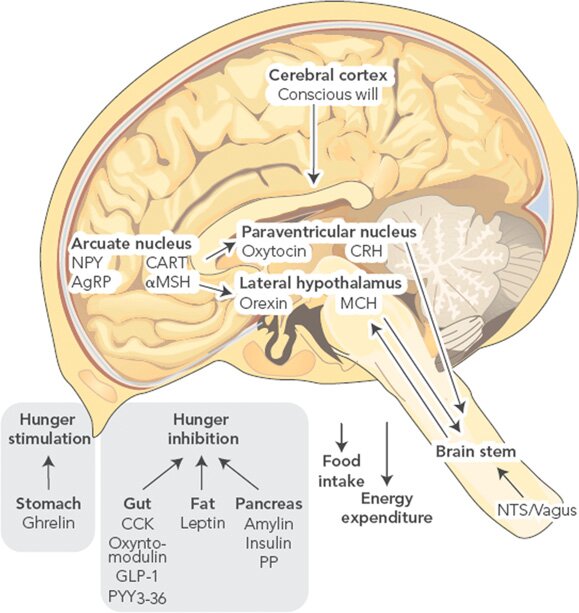
Рисунок 1. Отдельные пути, участвующие в регулировании массы тела.
CART – кокаин- и амфетамин-регулируемые транскрипты; αMSH – α-меланоцит-стимулирующий гормон. Рисунок воспроизведён по: Proietto J. Why is treating obesity so difficult? Justification for the role of bariatric surgery. Med. J. Aust. 2011;195(3):144–146.
Гедоническое влияние на аппетит
Если бы аппетит контролировался только гомеостатическими механизмами, мы ели бы только для удовлетворения потребности в пищи, что явно не так. В дополнение к гомеостатическим путям, гипоталамус получает входные сигналы от коры и зон вознаграждения в лимбической системе («гедонические» пути), связанные со зрением, запахом и вкусом пищи, наряду с эмоциональным и социальными факторами, которые объединяются для влияния на потребление и траты энергии. Гедонические пути могут перенастраивать гомеостатическую систему, увеличивая желание потреблять вкусные, высококалорийные продукты питания, даже когда запасы энергии и обеспечение пищей в изобилии.
Получены подтверждения существенного взаимодействия между гомеостатическим и гедоническим путями регуляции аппетита. Показано влияние лептина на пути вкуса и вознаграждения (39 – 41), грелин стимулирует мезолимбический дофаминергический путь и увеличивает потребление сладких продуктов (42, 43). Кроме того, стимуляция каннабиноидных рецепторов 1 (CB 1), которые широко распространены в ядрах гипоталамуса и стволе мозга, как известно, имеет решающее значение в гомеостатическом контроле аппетита (44), увеличивая не только потребление пищи, но и предпочтение вкусных продуктов (45), что показывает влияние на приём пищи через не-гомеостатические пути вознаграждения.
Физиологическая адаптация к потере веса
Накапливаются доказательства того, что потеря веса, вызванная ограничением питания, приводит к компенсаторным изменениям нескольких биологических путей, участвующих в утилизации и хранении энергии, а также регулировании аппетита, что в совокупности предрасполагает к восстановлению веса (приведены в таблице 2). Некоторые из этих изменений больше выражены в процессе потери веса, чем после стабилизации пониженной массы тела. Тем не менее, недавние исследования показали, что многие из этих изменений представляют не только преходящие явления в динамике потери, но и сохраняются в течение года и более после снижения веса.
Таблица 2.
Физиологические изменения после снижения веса, вызванного ограничениями питания
| Фактор | Ожидаемое влияние |
|
↓ Расход энергии ↓ Окисление жиров ↓ Тироидные гормоны ↑ Кортизол |
Увеличение накопления энергии |
|
↑ GIP ↓ Лептин ↓ PYY ↓ Амилин ↓ Инсулин ↑ Грелин ↑ Аппетит Изменения нейроактивации |
Увеличение потребления пищи |
| Панкреатические полипептиды | ? Снижение потребления пищи |
Расходование энергии
Общий расход энергии (ТЕЕ) у человека складывается из трёх компонентов: 1) расход энергии в покое (REE) – состоит из таких процессов, как поддержания трансмембранных ионных градиентов и активности кардио-респираторной системы в покое; 2) термического эффекта пищи (TEF) – энергия необходимая для потребления, транспорта и депонирования нутриентов; 3) расходов энергии на активность (NREE) – в основном, на физическую активность. У людей со стабильным весом соотношение между REE, TEF и NREE составляет 60, 10 и 30%, соответственно (46).
Вызванное диетой уменьшение веса на 10% ведёт к снижению TEE на 15% ниже того, который можно объяснить, учитывая изменения в составе и массе тела как у худых, так и у людей с ожирением (46). Степень действительного снижения REE остаётся спорной (47 – 49); тем не менее, больше, чем предполагаемое уменьшение NREE, составляющее основу снижения ТЕЕ, вероятно, в основном, за счёт увеличения эффективности скелетных мышц, особенно при низких нагрузках (50, 51). Обнаружено, что это непропорциональное уменьшение ТЕЕ сохраняется более годы у людей, поддерживающих пониженную массу тела (52).
Метаболизм субстратов
Метаболизм субстратов в значительной степени зависит от ряда факторов, в том числе: энергетического баланса (то есть, стабильный вес по сравнению с динамическими изменениями веса), физической активности и состояния питания (соотношения макронутриентов, а также измерения в голодном или сытом состоянии) (53, 54). Исследования проводили с использованием в качестве модели грызунов с ожирением, вызванным питанием. Они оценивали состояние во время развития ожирения, лечения и рецидивов, что нельзя воспроизвести с организмом человека. У тучных крыс (вследствие переедания) ограничение пищевой энергии сопровождалось понижением небелкового дыхательного коэффициента (RQ), которое показывало преимущественное использование жиров по сравнению с углеводами (55). После перехода к поддержанию пониженной массы тела произошёл сдвиг в предпочтительных субстратах в сторону использования углеводов, который сохранялся до восстановления веса (55). Утилизация углеводов позволяла сохранять пищевые жиры для депонирования. Ряд исследований с участием людей также показали, что люди со стабилизацией веса, ранее страдавшие ожирением, имели более низкий уровень окисления жиров натощак и за 24 часа, по сравнению контрольной группой или людьми с нарушенной способностью к окислению жиров в результате питания с высоким содержанием жиров (56 – 61). Это может привести к положительному балансу жиров и отрицательному балансу углеводов (57, 60), что вероятно стимулирует потребление пищи для восстановления запасов гликогена (62). Лонгитюдные исследования показали, что высокий RQ натощак или за 24 часа (низкое окисление жиров) связан с увеличением массы тела с течением времени (63 – 65). После прекращения программы по снижению веса наблюдалась существенная корреляция у тучных женщин, снизивших вес, между изменениями RQ и восстановлением массы тела в течение периода наблюдения (r = 0.89, P < 0.01) (66). В отличие от пониженного базального окисления жиров за 24 часа, утилизация жиров при выполнении низкоинтенсивной тренировки (нагрузка соразмерна повседневной активности) была выше после снижения веса в результате диеты, по сравнению со значениями до потери веса (50, 67). Это объясняется понижением активности ферментов, окисляющих углеводы, по отношению к ферментам, окисляющим жиры (67). Было высказано предположение, что это может быть связано с увеличением эффективности скелетных мышц, более метаболически эффективные медленносокращающиеся волокна получают большую часть энергии от окисления жиров, чем преимущественно гликолитические (менее эффективные) быстросокращающиеся волокна, несмотря на то, что биопсия не выявила изменения типов волокон (67).
Автономная нервная система
Ожирение связано с чрезмерной активностью симпатической нервной системы (SNS) в покое (68, 69). Доказано, что это может быть не только результатом ожирения (66, 70 – 73), но также предрасполагающим фактором его развития (74, 75). Хроническая чрезмерная активность SNS способна привести к снижению чувствительности или отрицательной негативной модуляции адренорецепторов (76), в связи с этим была выдвинута гипотеза, что вследствие понижения отзывчивости SNS уменьшается расход энергии, термогенез после приёма пищи и окисление жиров (77, 78). Убедительно показано, что у людей с ожирением уменьшение веса за счёт диеты сопровождается существенным снижением симпатической активности и увеличением парасимпатической функции сердца (73, 79 – 81). Увеличение парасимпатического влияния ослабляется при продолжительном (4 месяца) поддержании пониженного веса и при его повторном наборе (81 – 83). В то же время недавнее исследование показало расходящиеся эффекты поддержания нового веса на маркеры симпатической функции: при устойчивом снижении влияния норадреналина в организме восстанавливалась активность SNS в мышцах. Это подразумевает либо дополнительное снижение симпатического влияния в других органах или тканях, либо несоответствие между симпатической активацией нервов и высвобождением норадреналина во время поддержания пониженного веса (83).
Ось гипоталамус-гипофиз-щитовидная железа
 В нормальных условиях тиротропин-высвобождающий гормон (TRH), выделяемый паравентрикулярными ядрами гипоталамуса, вызывает секрецию тироид-стимулирующего гормона (TSH) в передней чести гипофиза, в результате щитовидная железа производит и выделяет тироксин (Т4) и трийодтиронин (Т3). Т4 конвертируется в более биологически активный Т3 в периферических тканях мишенях. Тироидные гормоны играют важную роль в расходовании энергии (84, 85). Взрослые, получающие Т4 в качестве заместительной терапии при гопотироидизме, REE существенно отрицательно коррелирует с TSH. И это проявляется при небольших изменениях дозы тироксина, даже когда уровни тироидных гормонов поддерживаются в пределах нормальных значений (84). Часть этого увеличения REE возможно вызвано разобщением процесса дыхания в митохондриях скелетных мышц, которое происходит при повышении уровней тироидных гормонов в кровотоке (86). Важность тироидных гормонов для адаптивного термогенеза продемонстрирована на крысах с удалённой щитовидной железой, проявляющих снижение температуры при попадании на холод. Замещение Т4 предотвращало этот эффект, если не блокировалось преобразование Т4 в Т3 в бурой жировой ткани (87). Ограничение энергии в большинстве случаев подавляет ось гипоталамус-гипофиз-щитовидная железа, что проявляется в уменьшении секреции TSH в ответ на TRH, понижении циркулирующих TSH и Т3, а также увеличении продукции неактивного rT3, с вариабельным влиянием на свободный и общий Т4 (72, 88 – 93). Изменения в Т3, rТ3 и Т4 возвращаются к исходному уровню при поддержании пониженного веса в некоторых (90, 91, 94, 95), но не во всех (72, 96) исследованиях.
В нормальных условиях тиротропин-высвобождающий гормон (TRH), выделяемый паравентрикулярными ядрами гипоталамуса, вызывает секрецию тироид-стимулирующего гормона (TSH) в передней чести гипофиза, в результате щитовидная железа производит и выделяет тироксин (Т4) и трийодтиронин (Т3). Т4 конвертируется в более биологически активный Т3 в периферических тканях мишенях. Тироидные гормоны играют важную роль в расходовании энергии (84, 85). Взрослые, получающие Т4 в качестве заместительной терапии при гопотироидизме, REE существенно отрицательно коррелирует с TSH. И это проявляется при небольших изменениях дозы тироксина, даже когда уровни тироидных гормонов поддерживаются в пределах нормальных значений (84). Часть этого увеличения REE возможно вызвано разобщением процесса дыхания в митохондриях скелетных мышц, которое происходит при повышении уровней тироидных гормонов в кровотоке (86). Важность тироидных гормонов для адаптивного термогенеза продемонстрирована на крысах с удалённой щитовидной железой, проявляющих снижение температуры при попадании на холод. Замещение Т4 предотвращало этот эффект, если не блокировалось преобразование Т4 в Т3 в бурой жировой ткани (87). Ограничение энергии в большинстве случаев подавляет ось гипоталамус-гипофиз-щитовидная железа, что проявляется в уменьшении секреции TSH в ответ на TRH, понижении циркулирующих TSH и Т3, а также увеличении продукции неактивного rT3, с вариабельным влиянием на свободный и общий Т4 (72, 88 – 93). Изменения в Т3, rТ3 и Т4 возвращаются к исходному уровню при поддержании пониженного веса в некоторых (90, 91, 94, 95), но не во всех (72, 96) исследованиях.
Ось гипоталамус-гипофиз-надпочечники
CRH выделяется из PVN в ответ на стресс, и это приводит к выделению из передней доли гипофиза адренокортикотропного гормона (ACTH) и к продукции кортизола, минералокортикоидов и андрогенов в надпочечниках. Избыток кортизола (например, при синдроме Кушинга) ведёт к увеличению массы тела, в частности жироотложения по центральному типу. Обнаруживается существенная корреляция между увеличением аппетита и кортизолом в плазме после программы по снижению веса у мужчин и женщин с ожирением (97). Исследование на крысах продемонстрировало, что кортизол ингибирует подавляющее действия лептина на потребление пищи и аппетит (98). Показано увеличение кортизола в кровообращении и подавление дексаметазона или суточных колебаний продукции кортизола (91, 99 - 102), хотя и не всегда (103) у худых и тучных людей после уменьшения потребления пищи, особенно при значительных ограничениях энергии. Изменения метаболизма кортизола обратимы после возвращения к неограниченному потреблению пищи (99).
Гормоны адипоцитов и желудочно-кишечного тракта, регулирующие аппетит
После снижения массы тела происходит снижение концентрации в кровотоке множества периферических гормонов, вовлечённых в регуляцию аппетита. Несмотря на некоторые несоответствия, которые, по-видимому, вызваны существенными различиями в методологии между исследованиями (включая характеристики пациентов, вариант диеты, степень снижения веса, продолжительность эксперимента и определения гормонов), в большинстве обнаружено, что снижение веса сопровождается гормональными изменениями, которые совместно способствуют восстановлению массы тела и энергетического баланса.
Лептин воздействует на гипоталамус, снижая потребление пищи и увеличивая расход энергии за счёт уменьшения экспрессии AgRP, NPY и стимуляции POMC (104 – 106). Когда человек поддерживает энергетический баланс при обычном весе, секреция лептина пропорциональна массе жира (107). В соответствии с его предполагаемой ролью в качестве сигнала истощения энергии (108), уровни лептина значительно снижаются после ограничения питания (109 – 111) и существенно ниже в процессе уменьшения веса, чем при поддержании достигнутого снижения (112). Приём лептина людьми с постоянным весом оказывает незначительное влияние на массу тела и аппетит (113), тогда как применение при дефиците энергии снижает аппетит (114). У людей со стабильным весом после его снижения «замещение» лептином предотвращает восстановление массы тела, вызывая множество адаптивных физиологических изменений, включая тироидные гормоны, автономную нервную систему, аппетит, расход энергии, эффективность скелетных мышц и региональную активацию мозга (72, 115, 116). Другие гормональные изменения вследствие понижения веса диетой, включают увеличение циркулирующего грелина, желудочного ингибирующего пептида (GIP) и РР, а также снижение PYY, CCK инсулина и амилина (59, 111, 117 – 122). Сообщается об увеличении, снижении или отсутствии изменений секреции GLP-1 после потери веса (111, 123, 124). Все вышеперечисленные гормоны уменьшают потребление пищи (27, 29, 30, 35 – 37), кроме грелина, который вызывает голод (28), и GIP, способного принимать участие в депонировании энергии (125). Таким образом, можно видеть, что почти все ожидаемые изменения направлены на восстановление утраченного веса, путём увеличения голода, уменьшения сытости и облегчения запасания энергии.
Согласно последним данным, описанные гормональные изменения не просто преходящие характеристики в ответ на отрицательный энергетический баланс. В исследовании, проведённом нашей группой (111), 50 мужчин и женщин с избыточным весом или ожирением, прошли 10-недельную программу по снижению веса на основе питания с очень низкой калорийностью. 1 год они старались поддерживать достигнутые изменения веса. Субъекты должны были потерять не менее 10% веса от исходного, а периферические, регулирующие аппетит гормоны измерялись у 34 участников, закончивших исследование с исходным весом, по окончании периода сброса веса и спустя 1 год. Изменения массы тела достигли (среднее значение ± S.E.M.) 13,5 ±0.5 kg (14% от исходной массы тела), испытуемые поддержали снижение –7,9±1,1 кг спустя 1 год. Потеря веса сопровождалась существенным снижением в кровотоке лептина, PYY, CCK, инсулина и амилина, а также повышением грелина, GIP и РР, которые имели место спустя 1 год даже в случаях восстановления массы тела.
Субъективный аппетит
В соответствии с ожидаемыми влияниями гормональной адаптации к снижению веса описано устойчивое увеличение субъективного аппетита вследствие снижения веса у взрослых людей с ожирением (97, 111). Подтверждается не только увеличение аппетита самого по себе (увеличивается чувство голода, желание поесть и предполагаемое потребление пищи) после снижения веса при помощи диеты (97, 111), но также и восприятие пищи как поощрения (126) и предпочтение высококалорийных продуктов. В одном исследовании сравнивали вкусовые предпочтения у людей с нормальным, повышенным весом, ожирением и страдавших от ожирения в прошлом. Предлагались растворы с различным содержанием сахаров и жиров. В группе людей, страдавших от ожирения, средняя потеря массы тела от низкокалорийной диеты составила 31 кг, они сохранили массу тела пониженной, по крайней мере, на 13,6 кг за год и более от уровня до исследования. Оптимальный раствор для группы с нормальным весом содержал 20% жиров и <10% сахарозы, группа с ожирением предпочла раствор с высоким содержанием жиров, а группа страдавших ожирением ранее выбрала раствор с высоким содержанием сахаров и жиров (127). Согласно данным нескольких экспериментов, изменения в аппетите после снижения массы тела связаны с изменениями лептина в кровотоке (97, 110, 128).
Активация регионов мозга
 Исследования с использованием методов визуализации функций мозга предоставили ценную информацию об изменениях в деятельности структур мозга в ответ на пищевой стимул у людей с ожирением после снижения веса при помощи питания. В одном исследовании обнаружили повышенную нервную деятельность в лимбической (вознаграждения) системе и областях, участвующих в исполнительной функции и принятии решений. При этом уменьшалась активность гипоталамуса и регионов, ответственных за эмоциональный контроль принятия пищи, которые интегрируют функции когнитивного контроля и планирования движения, по сравнению с исходными уровнями у людей с ожирением, снизивших вес (116). Это может указывать на состояние повышенной чувствительности к пищевому поощрению наряду с пониженным контролем потребления пищи. В других исследованиях показано, что в ответ на предъявление пищевого стимула люди, уменьшившие ожирение, обнаруживали изменения в активации нескольких регионов мозга, вовлечённых в контроль сложных аспектов пищевого поведения, по сравнению с худыми и имеющими ожирение людьми, включая: островок, нижнюю зрительную кору, заднюю часть поясной извилины, задний гиппокамп и миндалевидное тело (129, 130). В одном эксперименте региональный мозговой кровоток повышался в середине островка в ответ на дегустацию жидкой пищи у людей с ожирением и уменьшивших ожирение, но не у худых людей (130). В другом эксперименте активация островка и нижней зрительной коры в ответ на изображение аппетитной пищи, по сравнению с непродовольственными картинками была не такой сильной у людей, снизивших вес при ожирении, по сравнению с худыми людьми в нормокалорийном состоянии. Тем не менее, после 2 дней усиленного питания пищевой ответ в островке и гипоталамусе стал значительно слабее у худых, но не у снизивших вес субъектов, что свидетельствует о возможном нарушении способности ощущать положительный баланс энергии после снижения веса (129). Помимо другой активности, островок является посредником в пищевых предпочтениях (131). Активация этой области в ответ на изображение высококалорийных продуктов стимулируется грелином (132) и ослабляется введением лептина у взрослых людей, уменьшивших ожирение или с врождённой недостаточностью лептина (116, 133).
Исследования с использованием методов визуализации функций мозга предоставили ценную информацию об изменениях в деятельности структур мозга в ответ на пищевой стимул у людей с ожирением после снижения веса при помощи питания. В одном исследовании обнаружили повышенную нервную деятельность в лимбической (вознаграждения) системе и областях, участвующих в исполнительной функции и принятии решений. При этом уменьшалась активность гипоталамуса и регионов, ответственных за эмоциональный контроль принятия пищи, которые интегрируют функции когнитивного контроля и планирования движения, по сравнению с исходными уровнями у людей с ожирением, снизивших вес (116). Это может указывать на состояние повышенной чувствительности к пищевому поощрению наряду с пониженным контролем потребления пищи. В других исследованиях показано, что в ответ на предъявление пищевого стимула люди, уменьшившие ожирение, обнаруживали изменения в активации нескольких регионов мозга, вовлечённых в контроль сложных аспектов пищевого поведения, по сравнению с худыми и имеющими ожирение людьми, включая: островок, нижнюю зрительную кору, заднюю часть поясной извилины, задний гиппокамп и миндалевидное тело (129, 130). В одном эксперименте региональный мозговой кровоток повышался в середине островка в ответ на дегустацию жидкой пищи у людей с ожирением и уменьшивших ожирение, но не у худых людей (130). В другом эксперименте активация островка и нижней зрительной коры в ответ на изображение аппетитной пищи, по сравнению с непродовольственными картинками была не такой сильной у людей, снизивших вес при ожирении, по сравнению с худыми людьми в нормокалорийном состоянии. Тем не менее, после 2 дней усиленного питания пищевой ответ в островке и гипоталамусе стал значительно слабее у худых, но не у снизивших вес субъектов, что свидетельствует о возможном нарушении способности ощущать положительный баланс энергии после снижения веса (129). Помимо другой активности, островок является посредником в пищевых предпочтениях (131). Активация этой области в ответ на изображение высококалорийных продуктов стимулируется грелином (132) и ослабляется введением лептина у взрослых людей, уменьшивших ожирение или с врождённой недостаточностью лептина (116, 133).
В исследовании сравнивали девять людей, страдавших ранее ожирением, и 20 людей с ожирением, не регулирующих питание. Те, кто успешно применил ограничения питания, обнаруживали большую активацию задней префронтальной коры (области, участвующей в когнитивной регуляции поведения) и меньшую активацию орбитофронтальной коры (региона, отвечающего за оценку вознаграждения сенсорных и висцеральных входов) после еды, чем у не соблюдающих диету. Эта модель активации была связана с более высоким уровнями пищевых ограничений у успешно соблюдавших диету (134).
Стратегии для успешного поддержания сниженного веса
В большинстве развитых стран окружающая обстановка способствует развитию ожирения, различные физиологические адаптации для восстановления массы тела препятствуют людям с ожирением в поддержании диеты. Большинство со временем опять набирают вес. Несмотря на это, есть люди, изменившие вес и поддерживающие достигнутую массу тела долгое время. Большая часть опубликованных данных относительно этих успешных случаев по снижению веса собраны в Национальном реестре контроля за весом (NWCR) – более 4000 взрослых в США, поддерживающих уменьшение не менее чем на 13,6 кг, по крайней мере, в течение года. Среди представителей реестра 97% люди белой расы, из них 80% - женщины, которые отбираются при помощи рекламных объявлений в газетах и журналах, а также на основе данных самооценки (135). Участники потеряли в среднем 30 кг и поддерживают снижение как минимум на 13,6 кг в среднем 5,5 лет (135). 83% сообщают, что побудительной причиной для их снижения веса наиболее часто является медицинские или эмоциональные случаи (136). Анализ стратегий для поддержания массы тела после снижения, о которых сообщили представители реестра, выявил несколько ключевых моментов для большинства участников:
-
Придерживаться питания с низким содержанием жиров и низкой калорийностью при минимальных вариациях. Участники сообщили о среднем потреблении 1306 (женщины) и 1685 (мужчины) ккал/день, при <25% калорий, поступающих из жиров. Это на 30% меньше, чем потребление энергии и жиров о котором сообщили респонденты NHANES III (Третий национальный опрос по оценке питания и здоровья) (137). Кроме того, большинство участников NWCR питаются с минимальными вариациями соотношения групп продуктов и придерживаются этого правила в выходные и праздничные дни. Речь о тех, у кого меньше всего шансов восстановить вес (138, 139).
-
Ежедневный завтрак (78%) (138).
-
Частая самооценка. 78% участников NWCR взвешиваются как минимум раз в неделю и 50% подсчитывают калорийность или содержание жира (136).
-
Регулярное выполнение упражнений (91%): умеренно интенсивной активности, эквивалентное ходьбе 45 км/неделю или около 1 часа в день (136). Представители NWCR тратят больше времени на физическую активность, в частности высокой интенсивности, чем люди со стабильным весом - как худые, так и с ожирением (136, 140).
-
Ограниченное время просмотра телепередач. 62% сообщили о просмотре телевизора менее 10 часов / неделю, тогда как средние данные для США составляют 28 часов (141).
Принимая во внимание, что компенсационная адаптация к потере веса приводит к уменьшению расхода энергии и повышенной склонности к накоплению жира, применение указанной выше стратегии выглядит идеальным способом предотвращения набора веса после похудения. Тем не менее, для любого человека долговременное следование участникам NWCR стратегии представляет чрезвычайную сложность. Что уж говорить о людях, снизивших вес, у которых увеличился аппетит, в обстановке, где они окружены пищей, особенно, когда окружающая среда не способствует поддержанию физической активности, например, средства транспорта (142). Это подтверждается фактом, что даже в успешной группе NWCR, распространено восстановление массы тела, и очень мало людей повторно сбрасывают вес после его восстановления (142).
Успех хирургических процедур, таких как LAGB и RYGB, вероятно связан с уменьшением аппетита после операций, в отличие от изменений аппетита, которые сопровождают нехирургические методы снижения веса (143, 144). Гормональная адаптация, способствующая набору веса, подобна при LAGB и при диетической потере веса, а механизм подавления аппетита после LAGB до конца не изучен (145). Гормональный профиль, который способствует подавлению аппетита, наблюдали после RYGB (118, 146, 147).
Перспективные направления
В настоящее время внимание сосредоточено на возможное участие кишечной флоры в абсорбции энергии и депонировании жиров, а также изменениях, вызванных потерей веса и преобладания различных видов кишечных микроорганизмов (148 - 151). Содействует ли какой-либо из этих факторов набору веса, ещё предстоит выяснить.
Несмотря на то, что сведения о физиологической адаптации к потере веса, которые поддерживают его восстановление, продолжают накапливаться, в настоящее время не существует нехирургических способов лечения с подтверждённой долговременной безопасностью и эффективностью, чтобы обойти эти изменения и помочь снизившим вес людям, страдающим ожирением, не способным поддерживать пониженный вес. В последние месяцы FDA предложила два препарата, подавляющих аппетит, для лечения ожирения: Лоркасерин (агонист рецепторов серотонина 2С) и сочетание фентермина и топирамата (Qsymia). Несмотря на пост-маркетинговые исследования, их безопасность для сердечно-сосудистой системы ещё предстоит установить. Представляется логичным, что восстановление гормонов, регулирующих аппетит до значений, предшествующих снижению веса, может облегчить поддержание достигнутых изменений, и действительно, многие биологические отклонения, которые сопровождают потерю веса, ослабляются после введения лептина в дозах, воспроизводящих исходное состояние (72, 115, 116, 152). У людей с ожирением, ограничивших потребление энергии с пищей, сочетание аналогов лептина (метрелептин) и амилина (прамлинтид) проявило синергетический эффект при снижении веса по сравнению только с приемом препарата или без него (153). Тем не менее, в 2011 году рандомизированное клиническое исследование было досрочно прекращено из соображений безопасности, и развитие комбинированной терапии с тех пор прекращено (пресс-релиз Takeda Pharmaceutical Company Ltd). Другими фармакологическими средствами, проходящими в настоящее время клинические испытания для лечения ожирения, являются аналог GLP-1 (лираглютид) и сочетание налтрексона и бупроприона (Contrave) (154, 155). Растущее число доказательств устойчивой физиологической адаптации к потере веса, которая способствует его восстановлению, оправдывает длительное применение лекарств с доказанной долгосрочной безопасностью и эффективностью для подавления аппетита и помощи в поддержании сниженного веса.
Аббревиатуры
- AgRP – агути-связанный пептид;
- ARC – дугообразное ядро (медиобазальных отделов гипоталамуса);
- CCK - холецистокинин;
- CRH – гормон, высвобождающий кортикотропин;
- GIP – желудочный ингибирующий полипептид;
- GLP-1 – глюкагоноподобный пептид-1;
- LAGB – лапароскопическое бандажирование желудка;
- MCH – меланин-концентрирующий гормон;
- NPY - нейропептид Y;
- NREE – расход энергии при активности;
- NWCR (National Weight Control Registry) – Национальный реестр контроля за весом;
- POMC - проопиомеланокортин;
- PP – панкреатический полипептид;
- PVN – паравентрикулярные ядра;
- PYY – пептид YY;
- REE – расход энергии в покое;
- RQ – респираторный (дыхательный) коэффициент;
- RYGB – операция по шунтированию желудка Roux-en-Y;
- SNS – симпатическая нервная система;
- T3 – 3, 3`,5-трийодтиронин;
- rT3 – реверсивный (неактивный)T3;
- T4 – тироксин;
- TEE – общий расход энергии;
- TEF – термическое действие пищи;
- TRH – тиротропин-высвобождающий гормон;
- TSH – тироид-стимулирующий гормон.
Источник: https://portlandpress.com/














