Факторы риска остеоартроза тазобедренного сустава

Авторы: Morey J. Kolber, William J. Hanney, Scott W. Cheatham and Paul A. Salamh.
Перевод Сергея Струкова.
Согласно данным эпидемиологических исследований, тазобедренный сустав (ТБС) является источником постоянной боли у ~15% людей, с большей распространённостью у женщин и пожилых людей (8, 12, 45). Среди различных диагнозов с этиологией, вызывающей боль в ТБС, остеоартрит (ОА) (также известный как остеоартроз, или дегенеративное заболевание суставов) имеет наиболее значительные экономические последствия и вносит один из наибольших вкладов в глобальное бремя инвалидности (11).
ТБС занимает второе место после коленного сустава среди крупных суставов тела, поражаемых ОА (11, 14). Согласно научным данным, предполагаемая распространённость проявления симптомов ОА в области ТБС составляет 25%; таким образом, они проявляются у каждого четвёртого человека (37). Из-за дегенеративного характера ОА патология может развиваться и со временем привести к нарушению функций с заменой сустава, в качестве варианта вмешательства на конечной стадии у людей, не поддающихся консервативному лечению (6). Согласно научным данным, ускорение дегенеративного процесса и связанная с ним заболеваемость обуславливается различными демографическими характеристиками и факторами риска (13). Хотя не все факторы риска изменяемые, разумно предположить, что контроль факторов риска путём рекомендаций в отношении образа жизни могут замедлить развитие симптомов и, возможно, замедляют дегенеративные процессы.
Принимая во внимание распространённость ОА ТБС, вполне вероятно, что специалисты по силовой и кондиционной тренировке столкнутся с людьми, имеющими подтверждённый диагноз или риски. Поэтому знание факторов риска обеспечивает понимание рекомендаций по образу жизни и изменений при выборе упражнений, которые будут полезны для замедления каскада дегенеративных изменений и связанных с ним последствий. Цель данной статьи – предоставить обзор факторов риска, связанных с ОА ТБС. Научные данные, подтверждающие или опровергающие некоторые из общепринятых факторов риска, обсуждаются в контексте обеспечения специалиста по силовой и кондиционной тренировке научно обоснованными рекомендациями для клиентов.
Паталого-анатомические предпосылки
Хотя подробное обсуждение патогенеза ОА ТБС не является целью этой статьи, для понимания представленных в статье состояний и рекомендаций необходим краткий обзор. Читатели, интересующиеся более подробным обсуждением дегенеративных процессов, могут обратиться к классификационной схеме Международного общества по изучению остеоартроза (OARSI) (39). Краткое описание номенклатуры, используемой для описания патологических изменений, которые обсуждаются в этой статье, можно найти в приложении (см. Таблицу, Дополнительный цифровой контент http://links.lww.com/SCJ/A184).
ТБС является шаровидным суставом (Рисунок), состоящим из суставного хряща, субхондральной кости, синовиальной мембраны и капсулы сустава. На суставных поверхностях имеется аваскулярный (без сосудов) суставной хрящ, преимущественно состоящий из хондроцитов (клетки, производящие коллаген, выявляемые в здоровом хряще), окружённых матриксом, включающем протеогликаны, глюкозоаминогликаны и коллаген (39). Суставной хрящ защищает подлежащую субхондральную кость путём распределения нагрузки и уменьшения трения в суставе при нормальных движениях и активности. Здоровый суставной хрящ, как в ТБС без ОА (Рисунок), поддерживается в состоянии баланса между синтезом (построением) и деградацией (распадом) хряща. Синовиальная жидкость, которая в частности содержит гиалуроновую кислоту, обеспечивает питательными веществами сустав и обеспечивает вязкость, необходимую для поглощения нагрузок и уменьшения трения. По сути, синовиальная жидкость служит для смазывания здорового сустава.
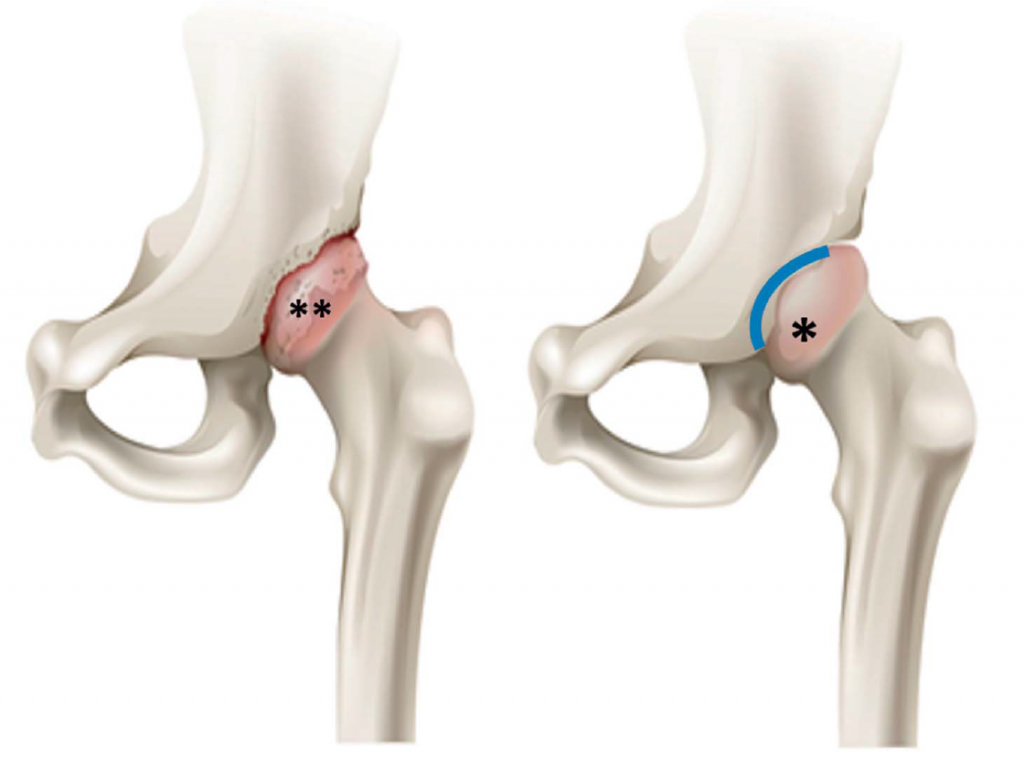
Рис. Сравнение ТБС с остеоартритом (на рисунке слева) и здорового ТБС (на рисунке справа).
* головка бедренной кости в здоровом ТБС; ** головка бедренной кости с дегенерацией суставного хряща; розовым оттенком отмечен суставной хрящ на головке бедренной кости; синяя линия показывает вертлужную впадину здорового сустава. Обратите внимание на разрастание кости и неправильную форму ТБС с артритом.
Состояние ОА ТБС можно рассматривать как дегенеративное суставное расстройство, связанное с нарушениями или биомеханическими повреждениями синовиальной мембраны, суставного хряща и субхондральной кости вследствие воспаления, предшествующей травмы и биомеханических нарушений (1, 20, 28, 35). В итоге ОА характеризуется прогрессирующим повреждением суставного хряща (на концах длинных костей в месте их соединения в сустав) (Рисунок). Со временем, происходит прогрессивная утрата хряща, называемая хондропенией. Хондропения приводит к уменьшению суставной щели, зачастую в области высокой нагрузки, например, в верхней части суставной щели. Эрозия сустава с потерей хряща и уменьшением суставной щели происходит до обнажения субхондральной кости (суставной хрящ исчезает). Эрозия ведёт к увеличению биомеханической нагрузки на субхондральную кость, которая реагирует процессом, известным как эбурнеация (39). Эбурнеация – состояние, при котором субхондральная кость подвергается склерозу и затвердеванию, напоминая на вид на рентгенограмме слоновую кость. Кроме того, изменения в субхондральной кости уменьшают способность к поглощению нагрузки, повышая риск травмы ТБС и воспалительных изменений. Более того, в областях с высокими нагрузками вдоль суставного края разрастается новая кость неправильной формы в процессе, называем остеофитозом (костные шпоры). Остеофитоз, как правило, происходит в результате реакции на локальную травму в определённой области сустава, восприимчивую к аномальной нагрузке.
Симптоматический ОА представлен набором гетерогенных признаков и симптомов, состоящих из гистологических и радиологических данных, совпадающих с нарушениями движения и болью. Этиология боли и нарушений при ОА ТБС многофакторная и предполагает нарастающее сочетание механизмов, включающих морфологические изменения в суставе, эпизоды воспаления и последующие нарушения (20). Симптомы (боль, скованность и слышимые звуки), возникающие при ОА ТБС не развиваются только вследствие повреждения суставного хряща. В частности, боль от ОА происходит от субхондральной кости (кость, расположенная под суставным хрящом) и изменениях в синовиальной мембране, которые активируют синовиальные ноцицепторы (рецепторы боли). Кроме того, боль может исходить от остеофитов, которые потенциально раздражаются при определённых движениях и положениях. Более того, отёк в суставе, возникающий при нагрузке на морфологически аномальные суставные поверхности, растягивают капсулу сустава (которая уже возможно укорочена из-за неиспользования и дегенеративных изменений) и является источником симптомов вследствие активности болевых рецепторов. Подобно другим состояниям, боль при ОА может быть вызвана химически, повреждением окружающих тканей (сумки или связки) или сопутствующей проблемой, например, мышечным спазмом, а также психологическими факторами. С точки зрения ухудшения состояния, возникают контрактуры сустава (укорочение мягких тканей), ведущие к боли, уменьшению подвижности и скованности в суставе.
Совместно упомянутые выше дегенеративные изменения и связанные с ними нарушения играют основную роль, приводя к боли и ухудшению состояния у клиентов с ОА ТБС. Более того, именно эти изменения и события зачастую приводят к проявлению клинических симптомов и формальным реабилитационным мероприятиям, ограничениям образа жизни и в социальной сфере, а также к снижению активности. К сожалению, нет данных, позволяющих выделить специфическое вмешательство для обращения дегенеративных процессов. Тем не менее, симптомы ОА (скованность, боль, слышимые звуки) и прогрессирование структурных изменений могут усиливаться определёнными факторами, некоторые из которых можно изменить при помощи рекомендаций относительно образа жизни и модификаций активности (13). Кроме того, многие последующие нарушения уменьшаются от безопасных тренировок и рекреационной активности (13).
Факторы риска
Факторы риска, в частности изменяемые (масса тела, модель тренировки, образ жизни, положение и нагрузки ТБС) представляют особый интерес для уменьшения числа новых случаев, применения профилактических мер и замедления развития заболевания (Таблица 1 и 2). Знание факторов риска и их роли в развитии заболевания поможет специалисту по силовой и кондиционной тренировке занять подходящую позицию для поддержки клиента и предложения соответствующей активности и изменений образа жизни. Кроме того, состояние клиентов с ОА ТБС или с установленными факторами риска потенциально может ухудшаться без надлежащих изменений в привычной деятельности. Соответствующие рекомендации по тренировкам и образу жизни, согласно научным данным, уменьшат риск нового проявления или ухудшения симптомом ОА ТБС и повысят уровень активности человека.
Таблица 1. Факторы риска, связанные с остеоартрозом ТБС (3, 10, 22, 26, 32, 34, 41, 48)
| Изменяемые факторы риска | Структурные или врождённые факторы риска |
| Вынужденные наклоны и приседания на работе | Дисплазия ТБС |
| Частые подъёмы по лестнице или воздействие вибрирующих инструментов | Болезнь Легга-Кальве-Пертеса |
| Продолжительное стояние и поднятие тяжестей | Эпифизеолиз головки бедра |
| Профессиональное занятие высоко ударными видами спорта | Дефекты хряща |
| Ожирение или высокий индекс массы тела (≥30) | Синдром бедренно-вертлужного соударения |
Таблица 2. Доказательства относительно рисков остеоартроза для занятий спортом и рекреации
| Тренировки и спорт: риск, связанный с остеоартрозом ТБС |
| Виды спорта, такие как американский футбол, лёгкая атлетика и виды с ракеткой – повышают риск |
| Частый подъём по лестнице – повышают риск |
| Рекреационный бег – НЕ повышает риск |
| Ходьба вместо бега – НЕ снижает риск |
| Езда на велосипеде или ходьба на досуге – НЕ повышает риск |
Демография
По расовому и этническому признакам, по-видимому, нет устойчивых различий в проявлении ОА ТБС (24). Как указано выше, половые различия существуют у женщин, поскольку у них чаще, чем у мужчин развивается симптоматический ОА ТБС (37, 38). Эти различия наиболее яркие после пятого десятилетия жизни (38). С возрастом растёт число случаев ОА ТБС, и наибольшее увеличение наблюдается в 50-летнем возрасте, со стабилизацией или снижением к 80 годам (4, 38). С возрастом учащаются сообщения о боли, связанной с ОА ТБС, что может объясняться прогрессом заболевания, а также нарушением и утратой функции. Хотя возраст и связан с ОА, он не является изменяемым фактором риска. Специалисту по силовой и кондиционной тренировке нужно учитывать увеличение распространённости с возрастом и растущую возможность возникновения дегенеративных изменений при разработке программ. Более того, в связи со старением и возможностью ОА, следует знать конкретные виды активности, которые, как известно, играют роль в проявлении симптомов и развитии заболевания. К счастью, в отношении признаков здоровья и тренированности, правильно подобранные упражнения задерживают необходимость операции по замене сустава и уменьшают симптомы ОА ТБС независимо от возраста (29, 40).
Перенесённые травмы
Травма или операция, затрагивающая суставной хрящ или поддерживающие структуры, может привести к нарушению биомеханики и дисбалансу цитокинов, который стимулирует или ускоряет процесс дегенерации. Цитокины – белки, выделяемые клетками и участвующие во многих взаимодействиях. Например, существуют провоспалительные и противовоспалительные цитокины, поэтому они могут способствовать воспалению или уменьшать его в зависимости от конкретного подтипа. Неадекватная нагрузка повреждённого прежде сустава может предрасполагать область к дегенерации, поскольку чрезмерно действующие силы ускоряют катаболический эффект и дальнейшее разрушение хрящевой матрицы. Перенесённые прежде травмы – явный фактор риска ОА с отношением шансов (ОШ) 5,0 (10, 41). По сути, у людей, перенёсших травму ТБС, в пять раз вероятнее развитие ОА по сравнению с людьми без травм. Во многих случаях прежняя травма создаёт изменения суставной поверхности и биомеханические нарушения, которые приводят к аномальной нагрузке.
Ключевым компонентом любой тренировочной программы должно быть знание истории болезни клиента. Выявление перенесённых травм или врождённых проблем ТБС представляет актуальные факторы риска. В отличие от прямой травмы, факторы образа жизни и профессии могут провоцировать дегенеративные изменения ТБС от микротравм.
Изменяемые факторы риска
Зачастую изменяемые факторы риска – виды активности, которые после изменений потенциально замедляют прогрессию и снижают риск новых случаев заболевания (Таблица 1). Медицинских работников и население в целом беспокоят физическая активность и нагрузки, т.к. систематические физические упражнения увеличивают износ и повреждения суставов (13). Научные данные действительно подтверждают связь между физической активностью и дегенерацией суставов. Но, согласно результатам исследований, умеренные физические нагрузки могут приводить к отмене операции и сокращению новых случаев симптоматического ОА (13). Физическая активность на досуге, например, ходьба или катание на велосипеде связаны со снижением риска дегенеративного ОА по сравнению с малоподвижным образом жизни (3). В целом, риск низок при рекреационных занятиях спортом (10), а вот активное участие в соревновательной деятельности и занятия спортом на высоком уровне до 50 лет связаны с большим риском ОА (46). В отличие от рекреации, виды спорта с высокими ударным нагрузками, такие как американский футбол, лёгкая атлетика и виды спорта с ракеткой, по-видимому, повышают риск ОА ТБС (43, 46). Риск для спортсменов более выражен у тех, кто соревнуется на высоком уровне с ОШ 1,6 – 2,5 (43). Такие виды активности, как рекреационный бег могут оказывать защитный эффект, отчасти из-за связи со снижением массы тела.
Большинство исследователей не выявили повышенного риска ОА ТБС у бегунов; тем не менее, данные, связанные с темпом и объёмом бега неоднозначны (36, 47, 48). В большом когортном исследовании результаты контрастны (риск ОА ТБС от бега не выявлен). Фактически, в одном исследовании установили, что у людей с большим расходом энергии риск ниже, чем у людей, тренирующихся с метаболическим эквивалентом <1,8 ч/день (48). Принимая во внимание, что 1 МЕТ – это расход энергии сидя в покое, можно интерпретировать вышеупомянутые МЕТ <1,8 ч/день, как нетренированных людей с другими присущими рисками. Тем не менее, в том же исследовании ходьба вместо бега не снижала риск ОА (48). Авторы пришли к выводу о защитном влиянии бега, в частности из-за меньшего нездорового увеличения массы тела, известного как фактор риска ОА. Принимая во внимание связь бега со снижением индекса массы тела (ИМТ), можно сделать вывод, что, по-видимому, рекреационная физическая активность не повышает риск развития ОА и фактически может улучшить профиль рисков человека.
Профессиональная активность, включающая подъёмы тяжестей, приседания, подъёмы по лестнице и долгое нахождение в положении стоя, связана с ОА ТБС (22, 41). Тяжёлые тренировочные нагрузки по сравнению с лёгкими, повышают риски развития ОА ТБС у отдельных лиц в три раза (33). Сообщается об ОШ 12,5 для частой или вынужденной ходьбы по лестнице (31). Согласно научным данным, поднимание тяжестей не менее 10 кг в течение >10 лет связано с ОА ТБС (22). Логично предположить, что при научно обоснованных рекомендациях для здоровых людей нужно предпочесть рекреационный бег, а не приседания или ходьбу по лестнице. Более того, выбранная профессия может быть сама по себе фактором риска. Клиентам с повышенным риском из-за профессии нужно представить соответствующие рекомендации, исключающие провоцирующие виды активности при тренировках (ходьба по лестнице, глубокие приседания и вибрационные платформы).
В нескольких исследованиях высокий ИМТ и ожирения признаны факторами риска ОА ТБС и ОШ в диапазоне 1,6 – 15,4 (2, 41). В одном исследовании ожирение (ИМТ≥30) связано с большей предрасположенностью к ОА ТБС с ОШ=2,18 (2). У людей с ОА ТБС из вышеупомянутого исследования ожирение связано с повышенным уровнем боли, увеличением скованности, снижением функции и ухудшением качества жизни. В недавнем мета-анализе сообщили, что увеличение ИМТ на пять единиц (например, с 32 до 37) связано с повышением риска ОА ТБС на 11% (23). Кроме механического влияния, ожирение может быть воспалительным фактором риска для ОА, так как оно связано с повышенными уровнями адипокинов (9), которые способствуют воспалению сустава. Существуют доказательства связи между ожирением и тяжёлым ОА ТБС, требующим полной замены сустава (вмешательство на конечной стадии ОА ТБС). В исследовании (26) оценивали 568 женщин с ИМТ выше или равном 35 кг/м2, которым заменили сустав. Авторы работы сообщили об относительном риске ОА ТБС 2,6 по сравнению с референтной популяцией. Несмотря на явную связь, люди с ОА зачастую выбирают малоподвижный образ жизни, по сравнению с референтной популяцией, что в итоге приводит к увеличению ИМТ и сохранению риска навсегда.
Нет доказательств положительного влияния на ОА ТБС отказа от курения и потребления алкоголя (13). Хотя курение определённо влияет на результаты после операции, отказ, по-видимому, не влияет на дегенеративный процесс. Разумеется, отказ от курения полезен для показателей здоровья.
Структурная морфология. Нарушения развития, такие как дисплазия (нарушение положения ТБС – часто проявляется при рождении), врождённый вывих бедра (вывих бедра при рождении – часто вследствие дисплазии), болезнь Легга-Кальве-Пертеса (нарушение кровотока в головке бедра, ведущее к некрозу кости) и эпифизеолиз головки бедра (перелом ростовой пластинки в головке бедра вызывающий соскальзывание головки бедра) связаны с ОА (21). Непосредственная нагрузка на диспластический при развитии сустав может предрасполагать область к дегенерации, так как чрезмерные силы ускоряют катаболическое влияние на хондроциты и дополнительно разрушают матрицу хряща.
Что касается морфологии, было высказано предположение, что неравенство длины нижних конечностей и бедренно-вертлужное соударение может быть связано с риском развития ОА ТБС (15). Сообщалось, что у людей с разницей длины ног (различие ≥2 см) более вероятен ОА ТБС, хотя связь слабая (скорректированное ОШ =1,20) и связь с радиографической прогрессией несущественная (17, 18). Примечательно, что в одном из исследований обнаружены более частые случаи ОА в относительно короткой ноге (ОА в правой ноге встречается чаще, когда левая нога длиннее) (18); но результаты получены лишь в этом исследовании. Одним из потенциальных недостатков данных о неравной длине ног является метод измерения, так как исследователи использовали рулетку (16 - 18). При рассмотрении вопроса неравенства конечностей нужно учитывать возможность несоответствия длины ног вследствие ОА ТБС самого по себе, и короткая нога может быть просто следствием сужения суставной щели или продавливания вертлужной впадины (медиальная протрузия головки бедра в вертлужную впадину), а не структурными изменениями длины. Независимо от радиографических изменений, у людей с неравномерной длиной ног чаще возникают боли и скованность в ТБС, чем при симметричной длине нижних конечностей (16). Связь слабая, несмотря на кажущуюся повышенную распространённость радиографического ОА ТБС и симптомов среди людей с разной длиной ног. Более того, по наличию неравенства длины ног нельзя прогнозировать прогрессию радиографических явлений или симптомов.
Синдром бедренно-вертлужного соударения – установленный фактор риска раннего ОА и замены сустава (5, 30, 32, 34, 42, 44). Механизм соударения головки-шейки бедра с вертлужной впадиной бывает в варианте CAM (несферическая головка бедра), вариант PINCER, обусловленный чрезмерным перекрытием вертлужной впадины и их сочетания. Вариант CAM чаще наблюдается у более молодых пациентов, и причиной считают отслаивающее повреждении хряща вертлужной впадины (хрящ «срезается» с кости). В варианте PINCER связан с соударениями губы, что приводит к её повреждению, дегенерации и оссификации. Читателям, желающим получить дополнительную информацию о синдроме бедренно-вертлужного соударения, рекомендуем ознакомиться с обзором Kolber et al (27) в Strength and Conditioning Journal за июнь 2015 года.
Практические рекомендации
Специалисты по силовой и кондиционной тренировке играют ключевую роль в назначении упражнений и рекомендациям по образу жизни для людей различного уровня тренированности (Таблица 3). Поэтому, учитывая распространённость ОА ТБС среди пожилых людей и возможность для специалиста выбрать работу с этой популяцией, полезно понимать факторы риска. Хотя некоторые факторы риска, такие как возраст и предшествующая операция, предотвратить нельзя, можно применить модификации, помогающие замедлить развитие ОА. Помимо этого, знание изменяемых факторов риска предоставляет возможности для тренировки и изменений образа жизни, не ограничиваясь лишь контролем подъёма веса, регулированием массы тела, предложением стандартной тренировки средней интенсивности и исключением провоцирующих положений. И наконец, знание соответствующих факторов риска и доказательств, подтверждающих их связь, позволяет осуществлять научно обоснованное руководство и вероятно предотвращает ошибочные рекомендации по прекращению на самом деле безопасной активности. Читатели, заинтересованные в комплексном подходе к оценке и лечению ОА ТБС, могут обратиться к Главе 6 работы Orthopedic Management of Hip and Pelvis (7).
Таблица 3. Практические рекомендации, уменьшающие риск ОА ТБС
| Откажитесь от малоподвижного образа жизни путём увеличения физической активности |
| Сохраняйте здоровую массу тела и при необходимости обратитесь за консультацией по питанию |
| Для людей с высоким риском* исключите вынужденные подъёмы по лестнице, глубокие приседания и продолжительное нахождение в положении стоя |
| * Например, возраст >50 лет, индекс массы тела ≥30, перенесённые травмы или нарушение развития ТБС. |
У большинства людей с диагнозом ОА, есть уровень боли, связанный с самим состоянием и некоторыми провоцирующими видами активности или движениями. Множество факторов риска связанны с ОА, включая (но не ограничиваясь): возраст, пол, травмы, генетика, опасные работы, врождённые факторы и предыдущие хирургические вмешательства. Раннее выявление изменяемых факторов риска может служить основой для программ профилактики, направленных на замедление развития заболевания и связанных с ним симптомов. Вероятно, положительно повлияют на проявления боли и физические функции как минимум безопасные физические тренировки (25), усилия по профилактике ожирения и модификации опасных профессиональных условий. Хоть возраст и нарушения развития, например, дисплазия не являются изменяемыми факторами риска, улучшение биомеханических условий за счёт исключения аберрантной нагрузки, наряду с сохранением разумного уровня физической активности, может уменьшить риск развития ОА. Читателям следует понимать: хотя некоторые виды физической активности, например, бег не считаются независимыми факторами риска ОА, их выполнение людьми с установленным диагнозом может ускорить развитие заболевания. Для начала любой тренировочной программы после постановки диагноза рекомендуется разрешение от врача.
Оригинал: http://journals.lww.com/














