Миостатин - отрицательный регулятор мышечной массы: революция или сенсация?

Читательской аудитории этого журнала хорошо известно значение поддержания нормального функционального состояния скелетной мускулатуры для здоровья и долголетия. Известны им и различные состояния, сопровождающиеся потерей или риском потери мышечной массы, такие, как:
- продолжительные периоды отсутствия нормальной физической активности (длительный постельный режим, пребывание в невесомости),
- травмы, приводящие к длительной иммобилизации групп мышц,
- онкологические заболевания,
- ряд осложнений химиотерапии,
- сепсис, некоторые острые и хронические инфекции, включая СПИД,
- старческая саркопения (потеря мышечной массы), начинающаяся фактически после 40 лет.
Очевидно, что знание способов регуляции величины мышечной массы имело бы огромное терапевтическое значение и означало бы значительное снижение риска осложнении и даже летальных исходов.

Рис. 1. Бык породы Belgian Blue (Бельгийская голубая).
Так, например, установлено, что у пациентов с хроническими обструктивными легочными заболеваниями именно уменьшение индекса мышечной массы ниже определенной величины, а не индекса массы тела в целом, наиболее точно коррелирует со смертностью (Marquis К., et al., 2002).
Наряду со значительным увеличением всех мышечных групп видно практически полное отсутствие подкожной жировой ткани.
В течение последних десятилетий поиски путей восстановления и увеличения мышечной массы велись не только с помощью низкомолекулярных анаболических и антикатаболических препаратов, а также биологически активных пищевых добавок, но и на уровне поиска генов ответственных за гомеостаз мышечной ткани. Объектом для обнаружения таких генов были, в частности, и породы мясного скота с фенотипом так называемой «удвоенной мышечной массы» (породы «Бельгийская голубая» и Piedmontese). Переломным в этих поисках стал 1997 год. Первоначальный успех был достигнут благодаря генно-инженерным манипуляциям с мышами (так называемый метод генного нокаута). В лаборатории проф. Си-Джин Ли в университете им. Джона Хопкинса (Балтимор, США) были созданы мыши гомозиготные по повреждению гена фактора GDF-8 (Growth and Differentiation Factor 8 или, в переводе, - фактор роста и дифференцировки N8) (McPherron A. et al., 1997). У этих мышей в результате эксперимента произошло значительное (2-3 кратное) увеличение всех скелетных мышц. При этом, увеличилось как число мышечных волокон (гиперплазия), так и их толщина (гипертрофия). Полученные мыши были вполне жизнеспособны и давали потомство.
В результате этих экспериментов было доказано, что белок GDF-8 является отрицательным регулятором роста скелетных мышц и поэтому он получил название миостатин, а животные с таким дефектом - миостатин ноль мышей.
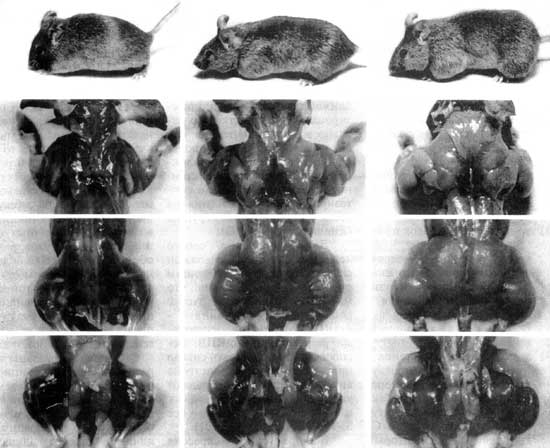
Рис. 2
После этого открытия в том же 1997 году в нескольких лабораториях клонировали и установили последовательность гена миостатина у крупного рогатого скота пород «Бельгийская голубая» и Piedmontese. Было обнаружено, что у этих животных имеются мутации в гене миостатина (различные в каждой из пород), которые тем или иным образом приводят к отсутствию функционально активного миостатина (McPherron A., Lee S-J., 1997; Grobet L. et al., 1997; Kambadur R. et al., 1997). В отличие от мышей с поврежденным геном миостатина у этих пород происходит только гиперплазия мышечной ткани без гипертрофии. Хотя применительно к этому мясному скоту используют термин "фенотип удвоенной мышечной массы", суммарное увеличение всех мышц составляет не более 40% по сравнению с другими мясными породами, но и это, безусловно, неоценимо для мясного животноводства. Рис. 1 показывает, как отсутствие функционально активного миостатина (ген миостатина работает, но синтезированный белок неактивен) приводит к увеличению мышечной массы.
Способность миостатина ограничивать рост мышечной массы сразу привлекла к нему внимание как к потенциальной мишени для терапевтического вмешательства при дегенеративных заболеваниях, травмах и других патологиях мышечной системы, а также - для применения в спортивной медицине и спорте.
Было установлено, что миостатин по своей структуре относится к белкам типа TGF-β (Transforming Growth Factor-beta, трансформирующий фактор роста-бета), которые представляют собой секретируемые факторы, необходимые как в ходе эмбриогенеза, так и во взрослом состоянии для тканевого гомеостаза.
Миостатин имеет общие структурные свойства с другими белками семейства TGF-β:
- гидрофобное ядро в районе N-концевой части молекулы, которое служит как секреторный сигнал;
- консервативный блок из четырех аминокислот в С-концевой половине молекулы, являющийся сигналом для процессинга (протеолитического расщепления в процессе образования активного белка из предшественника большей длины);
- девять остатков цистеина в С-концевой части молекулы, необходимых для образования функционально активной вторичной структуры. После процессинга С-концевой домен, который становится функционально активным миостатином, остается нековалентно связанным с N-концевой частью молекулы, которую в данном случае называют пропептидом;
- Миостатин, как и другие белки типа TGF-β , секре-тируется в виде неактивного комплекса с пропептидом.
Процесс экспрессии миостатина, возможно, регулируется белком Titin-cap (Nicholas G. et al., 2002), так как установлено, что синтез этого белка уменьшает выход миостатина из клеток. Секретированный в виде комплекса с пропептидом миостатин неактивен, так как не может связываться со своим рецептором. Для проявления активности миостатин должен быть отделен от пропептида. Активация миостатина осуществляется в результате расщепления пропептида протеазами типа катепсина D.
Считается, что основная масса синтезированного миостатина проявляет свое действие аутокринным и паракринным образом, т.е. миостатин действует внутри и в районе ближайшего окружения синтезировавшей его клетки, но недавно в экспериментах in vivo доказана возможность проявления его активности эндокринным образом, т.е. системное воздействие локально синтезированного миостатина на все мышечные группы (Zimmers Т. et al, 2002).
Для проявления своего действия миостатин должен связаться с соответствующим ему рецептором. Показано, что миостатин взаимодействует с рецепторами активина ActRIIB. Мыши с измененными рецепторами ActRIIB, неспособными передавать сигнал при связывании миостатина внутрь клетки, также обладают увеличенной мускулатурой, как и миостатин-ноль мыши (Lee S.-J. & McPherron A., 2001).
В эмбриогенезе экспрессия гена миостатина начинается в прогениторных клетках мио-генной линии и продолжается во взрослых аксиальных и параксиальных мышцах (McPherron A. et al., 1997). При этом уровень синтеза миостатина различен в разных скелетных мышцах (Kambadur R. et al., 1997).
Последующие исследования обнаружили экспрессию гена миостатина в ряде других тканей. Показано, что миостатин присутствует в кардиомио-цитах и волокнах Пуркинье в сердце (Sharma M., et al., 1999), синтез мРНК миостатина обнаружен в молочных железах (Ji S, et al., 1998) и в адипоцитах (Kim HS, etal, 2001).
Можно предполагать, что половые различия в количестве секретируемого миостатина, наряду с другими факторами, влияют на половой диморфизм в развитии скелетной мускулатуры. При одинаковом уровне
Синтеза мРНК миостатина, т.е. уровне экспрессии гена миостатина, уровень секретированного миостатина выше у женщин, чем у мужчин (McMahon et al., 2002).
Поскольку экспрессия гена миостатина начавшаяся в эмбриогенезе продолжается в постнатальных мышцах и мышцах взрослого организма, то миостатин, по-видимому, играет существенную роль на всех стадиях миогенеза и в тканевом гомеостазе скелетной мускулатуры во взрослом состоянии при воздействии различных функциональных стимулов, включая обездвиживание. Для более ясного представления места миостатина в мышечном гомеостазе на рис. 3 и 4 приведена общая информация схематически представляющая миогенез и регенерацию мышечной ткани.

Рис. 3. Схематическое представление этапов развития и дифференцировки мышечной ткани.
Активация генов MyoD и Myf5 дает начало миогенной линии клеток, прогениторные клетки (клетки-предшественники) дают начало миобластам. Активация гена миогенина коммитирует миобласты к последующей дифференцировке и пролиферации. Миостатин, активируя ген р21 и синтез Smad-белков, ограничивает (или останавливает) пролиферацию миобластов. Миобласты, прекратившие деление, переходят к стадии морфогенеза, то есть к закладке предшественников мышечных волокон - myotubes. Взаимодействуя друг с другом, они выстраиваются в цепочки и сливаются в вытянутые многоядерные клетки (синцитии). После слияния начинаются дифференцировка мембран, биохимическая и цитоплазматическая дифференцировка, в результате чего возникают окончательно сформированные зрелые мышечные волокна.
На рис. 3 показаны этапы развития и дифференцировки мышечной ткани. Эта схема составлена для отображения процессов происходящих в эмбриогенезе, но с небольшими отличиями она справедлива и для мышц взрослого организма.
Зрелые мышечные волокна - продукт конечной дифференцировки и неспособны к какому-либо делению, т.е., ни они сами, как структура в целом, ни клеточные ядра внутри волокон не могут делиться и рост мышц и регенерация осуществляются благодаря пролиферации сателлитных клеток, которые были открыты в 1961г., благодаря использованию электронной микроскопии (Mauro А.). Сателлитные клетки имеют размеры близкие к размерам клеточных ядер мышечных волокон и, как и эти ядра, находятся на периферии мышечных волокон, и только электронная микроскопия позволила установить, что они физически отделены от зрелых мышечных волокон и находятся между сарколеммой и базальной ламиной (Muir, A.R. et al., 1965).
В мышечных волокнах количество цитоплазмы, приходящееся на одно ядро, находится в определенных достаточно узких пределах (мионуклеарный домен). Увеличение размеров волокна (гипертрофия) достигается благодаря слиянию пролиферирующих сателлитных клеток с волокном, так что размеры мионуклеарного домена остаются в тех же пределах, что и до гипертрофии. Стимулом для деления (пролиферации) сателлитных клеток у взрослых организмов является, в первую очередь, миотравма, в том числе на уровне отдельного мышечного волокна. Участие сателлитных клеток в ответе на миотравму представлено на рис. 4. Выходя из состояния покоя, сателлитные клетки начинают экспрессировать миоген-ные маркеры, т.е., активируются гены характерные для миобластов. В процессе регенерации поврежденных скелетных мышц сателлитные клетки сливаются с существующими мышечными волокнами (гипертрофия) или между собой, создавая новые волокна (гиперплазия).
Определяя долю сателлитных клеток в мышечной ткани удобнее сопоставлять миофиб-риллы и сателлитные клетки по числу ядер, поскольку мышечные волокна многоядерны. Во взрослом состоянии ядра сателлитных клеток составляют 2-7% от общего числа ядер в различных мышцах. При рождении р ядра сателлитных клеток составляют около 30% от общего числа ядер в мышцах нижних конечностей (Schultz E. & McCormick K.M., 1994). Эти неонатальные сателлитные клетки пролиферируют и сливаются с растущими мышечными волокнами, привнося в них дополнительные ядра в ходе постнатального роста скелетных мышц.

Рис.4. Схематическое представление участия сателлитных клеток в регенерации мышечных волокон.
В ответ на миотравму сателлитные клетки активируются и пролиферируют. Часть клеток после деления возвращается в состояние покоя (для восстановления пула сателлитных клеток). Основная часть клеток в результате хемотаксиса мигрирует к поврежденным участкам и, в зависимости от степени повреждения, или сливается с поврежденным мышечным волокном или сателлитные клетки сливаются друг с другом, образуя новые волокна. Ядра недавно слившихся сателлитных клеток находятся в центре волокон, затем, по мере восстановления внутриклеточных структур волокна, мигрируют к периферии.
Таким образом, сателлитные клетки обеспечивают поддержание функционального состояния скелетных мышц взрослого организма, необходимы для восстановления поврежденных мышечных волокон и являются источником дополнительных ядер при гипертрофии мышц в результате тренировок. Гипертрофия и/или гиперплазия скелетных мышц у животных с отсутствием функционально активного миостатина доказывает, что миостатин влияет на пролиферацию сателлитных клеток, поскольку постнатальный рост мышц и увеличение числа ядер в мышечных волокнах в процессе развития до взрослого состояния происходит благодаря пролиферации сателлитных клеток.
При активации сателлитных клеток (выходе из состояния покоя) в них начинают работать гены характерные для миобластов и, таким образом, сателлитные клетки становятся, по сути, миобластами. Это означает, что степень пролиферации сателлитных клеток во взрослых мышцах также ограничивается миостатином, как и пролиферация миобластов в эмбриогенезе. Показано, что и белок TGF-β ингибирует пролиферацию сателлитных клеток в культуре (Allen R.E. & Boxhorn L.K., 1987).
Роль миостатина в гомеостазе зрелых мышечных волокон в полной мере пока не выяснена, но имеется ряд работ по исследованию уровня синтеза как мРНК миостатина, так и самого миостатина в мышцах во взрослом состоянии на животных моделях и у человека при различных физиологических состояниях.
Так системная сверхэкспрессия миостатина у мышей в течение двух недель приводит к потере свыше 30% общей массы тела и 50% по мышечной массе, то есть картина практически идентичная синдрому кахексии у человека. Эта работа доказала, что миостатин может действовать эндокринным образом. Введение ингибиторов миостатина пропептида или фоллистатина значительно замедляет потерю мышечной массы при повышенном уровне миостатина. Также важно отметить, что наряду с потерей мышечной массы происходит практически полная потеря подкожного жира, что также согласуется с данными о влиянии миостатина на дифференцировку адипоцитов (Zimmers Т.А. et al., 2002).
У людей разных возрастных категорий уровень миостатина в сыворотке крови наиболее высок у мужчин и женщин старше 72 лет и коррелирует со степенью саркопении. У мужчин и женщин среднего возраста уровень миостатина в сыворотке в свою очередь выше по сравнению с молодыми людьми. Индексы нежировой массы тела и мышечной массы тела обратно пропорционально коррелируют с сывороточным миостатином во всех возрастных категориях. Эти данные позволяют рассматривать миостатин не просто как биомаркер возрастной саркопении, но как супрессор мышечной массы. (Yarasheski K.E., et al., 2002).
Внутримышечная и сывороточная концентрации миостатина увеличены у больных СПИДом в стадии, когда наблюдается потеря мышечной массы, при этом концентрация миостатина обратно пропорционально коррелирует с индексом нежировой массы тела. Эти результаты показывают, что миостатин вносит вклад в потерю мышечной массы при СПИДе. (Gonzalez-CadavidN.E.et al., 1998).
В прямых экспериментах на крысах выявлено, что потеря мышечной массы, происходящая при космическом полете, связана с увеличением уровня миостатина в скелетных мышцах (2-5 кратное в различных мышцах к 17-му дню полета). Эти результаты показывают, что миостатин один из основных элементов в многофакторной патофизиологии мышечной атрофии происходящей при космическом полете (Lalani R., et al., 2000).
В наземных экспериментах на людях установлено, что к 25-му дню неподвижного режима (в качестве модели космического полета) уровень миостатина повышается на 12% (ZachwiejaJ. J. etal., 1999).
Иммобилизация мышц у мышей приводит к увеличению концентрации мРНК миостатина (экспрессии гена миостатина) в обездвиженных мускулах уже через 24 часа эксперимента, хотя потеря мышечной массы начинается лишь после третьего дня. Наиболее неожиданный результат, полученный в этих экспериментах, состоял в том, что синтез миостатина значительно различался в мышцах содержащих различные изоформы (варианты) тяжелой цепи миозина. При иммобилизации синтез миостатина значительно возрастал в быстрых мышцах, которые атрофировались к седьмому дню на 17%, в то время как m. soleus, в которой синтез миостатина не обнаруживался, атрофировалась к тому же дню на 42%. M. soleus состоит только из волокон типов I и IIа, тогда как m. gastrocne-mius и т. plantaris представляют собой типы IId/x и IIb, хотя и содержат типы I и IIа. (Carlson С. et al., 1999). Единственно приемлемое объяснение этого феномена - воздействие миостатина синтезированного m. gastrocnemius и т. plantaris на т. soleus, т.е. эндокринное воздействие.
Другое заключение состоит в том, что синтез миостатина коррелирует с типом волокон, т.е. синтез миостатина при иммобилизации мышц у мышей коррелирует с изоформой тяжелой цепи миозина IIb.
На мышиной модели мышечной дистрофии Дюшена (мыши линии mdx) показано, что блокада эндогенного миостатина путем внутрибрюшинных инъекций антител к миостатину в течение трех месяцев приводит к увеличению мышечной массы, размеров и силы мышц (Bogdanovich S., et al., 2002). Гибриды mdx-мышей с миостатин-ноль мышами имеют значительно лучшее состояние мускулатуры, чем исходные mdx-мыши (Wagner K.R. et al., 2002). Нормализация состояния мышц у mdx-мышей путем блокады миостатина или скрещивания с миостатин-ноль мышами открывает новые возможности для лечения патологий сопровождающихся потерей мышечной массы.
Баллу (Ballough W.S., 1962,1965) свыше тридцати лет назад высказал предположение о существовании тканеспецифических ингибиторов - кейлонов (chalones), которые, синтезируясь данной тканью, ингибирует ее рост и, таким образом, поддерживает адекватную массу этой ткани. Это предположение вполне подтвердилось в случае скелетной мускулатуры (Zimmers T.A. et al., 2002).
Очевидно, что искусственное ингибирование активности миостатина повлечет за собой революционные изменения в медицине и спорте и, возможно, будет использоваться в широких терапевтических целях (Lee S. J., McPherron А.С., 2001).
По материалам журнала "Физкультура в профилактике, лечении и реабилитации" №1 И. М.Ундрицов, В. М. Ундрицов, Э. Ф. Андреев. Московский центр медицинской косметологии и хирургии ЗАО «Лантан-Мед». НП Институт эффективного долголетия, Москва, Россия.