Увеличивают ли метаболиты гипертрофию мышц?

Авторы: Scott J. Dankel, Kevin T. Mattocks, Matthew B. Jessee, Samuel L. Buckner, J. Grant Mouser, Jeremy P. Loenneke.
Перевод Сергея Струкова.
Как правило, в рамках комплексной тренировочной программы людям рекомендуют тренироваться с отягощениями не менее двух раз в неделю (ACSM, 2009). Долговременная тренировка с отягощениями увеличивает массу мышц, что может улучшать самооценку (Hausenblas and Fallon 2006) и иметь клиническое значение, уменьшая риски хронических заболеваний (Wolfe, 2006). Поэтому необходимо лучшее понимание механизмов, регулирующих мышечный рост, для правильного составления программ тренировок и потенциальных терапевтических альтернатив упражнениям с отягощениями
Аббревиатуры:
1ПМ
– повторный максимум
АМРК
– АМФ-активируемая протеинкиназа
САМКII – кальций-кальмодулин зависимая протеинкиназа II
ЭМГ
– электромиография
FAK – киназа фокальных контактов
МАРК
– митоген-активируемая протеинкиназа
mTORC1 – комплекс мишени рапамицина млекопитающих 1
TSC2 – комплекс туберозного склероза 2.
Введение
Как правило, в рамках комплексной тренировочной программы людям рекомендуют тренироваться с отягощениями не менее двух раз в неделю (ACSM, 2009). Долговременная тренировка с отягощениями увеличивает массу мышц, что может улучшать самооценку (Hausenblas and Fallon 2006) и иметь клиническое значение, уменьшая риски хронических заболеваний (Wolfe, 2006). Поэтому необходимо лучшее понимание механизмов, регулирующих мышечный рост, для правильного составления программ тренировок и потенциальных терапевтических альтернатив упражнениям с отягощениями. В современных руководствах по физической активности людям, желающим увеличить массу мышц, рекомендуется тренировочная нагрузка не менее 70% от одноповторного максимума (ACSM, 2009). Но эта рекомендация не учитывает большой объём научных данных, показывающих аналогичное увеличение размеров мышц при сравнениях низких (30 – 50% ПМ) и высоких (75 – 90% ПМ) нагрузок, в случае их выполнения до отказа (Mitchell et al. 2012; Ogasawara et al. 2013; Morton et al. 2016). Кроме того, тренировка с ограничением кровотока также показывает увеличение размеров мышц, похожее на тренировку с малой нагрузкой до отказа (Fahs et al. 2015; Farup et al. 2015) и с большой нагрузкой (Laurentino et al. 2012). Мнение об аналогичной гипертрофии мышц от всех этих протоколов приводит многих (Schoenfeld 2013; Ozaki et al. 2015, 2016) к предположению, что разные режимы тренировки вызывают мышечный рост через альтернативные механизмы (например, метаболиты).
Поэтому цель обзора – обсуждение современных научных данных относительно роли метаболитов, образующихся при тренировке (лактат, неорганический фосфат), в регулировании вызванной упражнениями гипертрофии мышц. В частности, нас интересует ответ на вопрос: оказывает ли повышенное производство и/или длительное повышение концентрации метаболитов (в дополнение к тем, что обычно появляются при упражнениях с отягощениями) дополнительное влияние на мышечный рост? Нужно отметить, что, по нашему мнению, увеличение производства и/или длительное повышение метаболитов при упражнениях с отягощениями само по себе не имеет анаболических свойств, а скорее косвенно способствует гипертрофии, вызывая мышечное утомление и повышая активацию мышц. Повторные мышечные сокращения, по-видимому, имеют первостепенное значение для утомления мышцы и нагрузки большей части двигательных единиц. Несмотря на множество потенциальных механизмов с возможностью влияния на гипертрофию скелетных мышц при выполнении (кровоток, цитокины) или независимо (дополнительный приём аминокислот, тестостерона) от упражнений с отягощениями, в этом обзоре внимание сосредотачивается исключительно на вкладе метаболитов в гипертрофию мышц.
Как традиционные упражнения вызывают гипертрофию скелетных мышц?
Углублённый разбор молекулярных механизмов, регулирующих вызванную сокращениями гипертрофию, не является целью этой работы (см. обзор Marcotte et al. 2015), но мы представим читателям краткий обзор предполагаемых молекулярных механизмов, необходимый для понимания почему, по нашему мнению, согласно современным научным данным, у метаболитов нет непосредственных анаболических свойств. По современным представлениям, рост мышц от упражнений с отягощениями происходит благодаря процессу механотрансдукции, при котором стресс от сокращений мышц преобразуется в химические сигналы. Это предположительно происходит через связывание отдельных белков фокальных контактов, таких как киназа фокальных контактов (FAK), с формированием участков адгезии, путём соединения с рецепторами интегринов (Goldman, 2012). Формирование фокальных контактов опосредует процесс механотрансдукции, передавая напряжение, приложенное к мышечной клетке от внеклеточного матрикса внутрь и к ядру клетки (Goldman, 2012). Затем химические сигналы увеличивают массу мышц через активацию механозависимой части комплекса mTORC1, но этот комплекс не активируется только упражнениями с отягощениями, так как повышение активности mTORC1 вызывают также другие стимулы – факторы роста и аминокислоты (Marcotte et al. 2015). Специфический процесс активации mTORC1 упражнениями с отягощениями не вполне понятен, но в конечном счёте включает устранение комплекса туберозного склероза 2 (TSC2), что и позволяет активировать mTORC1 (Jacobs et al. 2017). Хотя упражнения с отягощениями также могут способствовать увеличению синтеза белка переносом комплекса mTORC1 в лизосомы, где он возможно активируется (Jacobs et al. 2017), и этому процессу содействует потребление аминокислот (Bar-Peled and Sabatini 2014). Таким образом, сочетание удаления ингибитора mTORC1 и переноса mTORC1 в лизосомы ведёт к значительной гипертрофии мышц (West and Baar 2013).
Могут ли метаболиты вызывать гипертрофию скелетных мышц через альтернативные механизмы?
Из-за низкой механической нагрузки предполагают, что гипертрофия мышц вследствие ограничения кровотока может происходит не только путём механотрансдукции (Pearson and Hussain 2015). В качестве альтернативы предлагаются измерения метаболитов внутри мышц (Suga et al. 2009, 2010, 2012) и в цельной крови (Takarada et al. 2000a, b; Takano et al. 2005), значительно накапливающихся при протоколах с ограничением кровотока, но обсуждение специфических методов измерения не является целью обзора. По идее, упражнения с ограничением кровотока активируют сигнальный путь митоген-активируемой протеинкиназы (MAPK) (Fry et al. 2010), не зависящий от нагрузки в упражнении (Dentel et al. 2005), что привело к гипотезе о метаболическом сенсоре (в отличие от механического сенсора), способном регулировать путь МАРК (Dentel et al. 2005), который обеспечивает потенциальный механизм роста мышц, независимый от нагрузки. Метаболиты с обычно предполагаемым анаболическим эффектом – те, что в наибольшей степени изменяются в ответ на протокол упражнений с ограничением кровотока (например, повышается лактат (Takarada et al. 2000a, b) и неорганический фосфат (Suga et al. 2012)), а значит, подобное повышение продукции метаболитов увеличивает мышечный рост. Объяснение выглядит правдоподобно, принимая во внимание увеличение размеров мышц при тренировке с отягощениями с ограничением кровотока по сравнению с тренировкой без ограничения кровотока при аналогичном количестве повторений (Nielsen et al. 2012).
В этом обзоре мы кратко обсудим доказательства анаболического потенциала некоторых метаболитов, предположительно усиливающих рост мышц при упражнениях с отягощениями. В разделе мы рассмотрим вышеупомянутые метаболиты с общеизвестным анаболическим влиянием, но не анаболический потенциал каждого метаболита, производимого при упражнениях с отягощениями. Важно понимать, что при тренировке с отягощениями образуется множество метаболитов, играющих определённую роль. Каждый образуемый метаболит нужно учитывать при долговременном изучении тренировки, хотя не существует исчерпывающих обзоров по каждому из возможных метаболитов, которые обнаруживаются после упражнений с отягощениями.

Среди метаболитов, производимых при упражнениях с отягощениями, лактат, по-видимому, наиболее подтверждённая анаболическая молекула для гипертрофии мышц (Nalbandian and Takeda 2016). Доказательства анаболических свойств лактата получены при исследовании клеточных культур, где он вызывал миогенез (Willkomm et al. 2014; Oishi et al. 2015) и увеличивал фосфорилирование p70S6K (нижележащая цель для mTORC1) (Oishi et al. 2015), подтверждая возможность стимуляции гипертрофии мышц метаболитами in vitro. Тем не менее, среди доказательств in vivo лишь одно исследование, показавшее, что 30 минут бега на тредмиле в течение четырех недель привело к большему приросту (по сравнению с тренировавшейся контрольной группой) массы мышц от орального приёма лактата (100 мг/кг) и кофеина (36 мг/кг) (Oishi et al. 2015). Авторы предположили, что лактат может оказывать анаболическое действие путём активации экспрессии белков в мышцах тренировавшихся крыс, включающее повышение миогенина (регулирующего дифференциацию клеток сателлитов), снижение миостатина (отрицательного регулятора роста мышц) и увеличение фоллистатина (ингибитора миостатина). Авторы предположили содействие анаболическому стимулу от приёма кофеина через повышение внутриклеточного кальция, но совместно принимаемые кофеин и лактат не оценивались независимо в исследованиях in vivo. Также возможно, что лактат увеличивает размеры мышц через непосредственное влияние на увеличение продукции тестостерона, показанное на клеточной культуре при добавлении лактата (10 ммоль в течение 1 ч) (Lin et al. 2001).т Тем не менее, согласно недавнему обзору (Nalbandian and Takeda 2016), эти данные не подтверждены in vivo. Даже если лактат повышает тестостерон у людей, срочное увеличение эндогенной продукции тестостерона от упражнений с отягощениями не увеличивает прирост размеров мышц (West et al. 2010). Есть некоторые данные, подтверждающие возможную анаболическую роль неорганического фосфата, но эта адаптация связана с костной тканью, а не со скелетными мышцами (Beck 2003; Spina et al. 2013). И наконец, есть свидетельства in vitro анаболического действия активных форм кислорода, путём стимуляции инсулиноподобного фактора роста-1 (ИФР-1), но этот эффект, по-видимому, дозозависимый, с потенциально негативным влиянием на сигнальные пути ИФР-1 высоких концентраций активных форм кислорода (Barbieri and Sestili 2012).
Несмотря на несколько опубликованных обзоров, выделяющих важность накопления метаболитов для индуцирования мышечного роста (Schoenfeld 2013; Ozaki et al. 2015, 2016), на сегодняшний день нет исследований (на людях), непосредственно подтверждающих больший прирост мышц от метаболитов, выделяющихся при упражнениях с отягощениями, чем от самих по себе сокращений мышц. Все доступные на сегодняшний день исследования, подтверждающие анаболическую роль метаболитов, просто указывают на связь метаболитов с ростом мышц. Иными словами, протокол исследования не предназначен для оценки роли метаболитов, потому что вместо воздействия на метаболическую среду изменяют какую-либо тренировочную переменную, что впоследствии приводит к большему накоплению метаболитов. Это очень важная концепция, поскольку уровень локального мышечного утомления (достижение или приближение к произвольному отказу мышц), вероятно, наиболее значимый фактор для мышечного роста (Mitchell et al. 2012; Morton et al. 2016) и это, по-видимому, связано с уровнем мышечной активации. Другими словами, метаболиты присутствуют, потому что повышенный уровень усилий требует большей утилизации энергии и большей продукции метаболитов, и поэтому скорее следствие сокращений, а не причина роста мышц.
Просто приведём несколько примеров исследований, спланированных для подтверждения роли метаболитов в индукции гипертрофии мышц:
- Гипоксические условия (Nishimura et al. 2010);
- Упражнения с ограничением кровотока (Takarada et al. 2000b);
- Сравнение эксцентрических и концентрических сокращений (Smith and Rutherford 1995);
- Кратковременные или длительные сокращения мышц (Schott et al. 1995; Tanimoto et al. 2008);
- Сравнение коротких и длинных периодов отдыха между множеством подходов упражнений (Kraemer et al, 1987; Villanueva et al. 2015);
- Периоды отдыха в пределах подхода (например, разделение подхода с 10 ПМ на два подхода по 5 повторений) (Goto et al. 2005).
В названии двух из этих исследований даже упоминалось: «Роль метаболитов в силовой тренировке» (Schott et al. 1995; Smith and Rutherford 1995), но непосредственная оценка роли метаболитов в силовой тренировке не проводилась. Фактически, ни в одном из вышеупомянутых исследований не оценивалось влияние метаболитов независимо от сокращений мышц, что существенно затрудняет определение: увеличился ли прирост вследствие самих мышечных сокращения или произведённых дополнительно метаболитов. Необходимо отметить, как это утверждалось прежде (Moritani et al. 1992), анаболические свойства метаболитов могут обуславливаться способностью увеличивать активацию мышц, и эта идея получила дальнейшее подтверждение (Loenneke et al. 2011) после того, как была показана малая значимость повышения концентрации гормонов (также считались действующими независимо от сокращения мышц) для роста мышц (West et al. 2010). Хотя утомление, по-видимому, многофакторное и нельзя отнести исключительно к метаболитам, при утомлении наблюдалось рекрутирование дополнительных двигательных единиц с более высоким порогом (Bigland-Ritchie et al. 1986).
Метаболиты могут вызывать рост мышц косвенно, путём рекрутирования двигательных единиц
Рекрутирование двигательных единиц, измеренное электромиографией
Накопление неорганического фосфата и ионов водорода может способствовать гипертрофии мышц путём нарушения цикла поперечных мостиков и индуцирования утомления мышц (Debold 2012). Амплитуда электромиографии (ЭМГ) часто используется для косвенного измерения рекрутирования двигательных единиц, на основании предположения, что большая активация двигательных единиц в заданное время произведёт больше потенциалов действия, а значит, амплитуда ЭМГ окажется выше. Ограничение кровотока показало увеличение амплитуды ЭМГ по сравнению с протоколами аналогичной нагрузки без ограничений (Yasuda et al. 2009; Lauver et al. 2017), хотя выполнение обоих видов протоколов до произвольного утомления привело к аналогичной амплитуде ЭМГ (Wernbom et al, 2009). Тогда как протоколы с равным количеством повторения привели к большему приросту мышц при использовании ограничения кровотока (Laurentino et al, 2012), тренировка до отказа устранила эти различия (Fahs et al. 2015; Farup et al. 2015), а значит, основное преимущество ограничения кровотока при упражнениях с отягощениями вероятно связано с большим утомлением мышц (Loenneke et al. 2012a).
Это подтверждается фактом: применение ограничения кровотока не увеличивает прирост мышц при упражнениях с высокой нагрузкой (Laurentino et al. 2008) и причина этому - невозможность увеличения активации мышц (Takarada et al. 2000b; Dankel et al. 2017a), поскольку упражнения с высокой нагрузкой уже достаточно утомительны. Если метаболиты могут вызвать мышечный рост независимо от традиционного каскада механотрансдукции, можно было бы получить преимущество от применения ограничения кровотока в упражнениях с высокой нагрузкой, но этого не происходит (Laurentino et al, 2008). Таким образом, более вероятно, что рекрутирование двигательных единиц с более высоким порогом возбуждения, а значит, большей долей мышечных волокон – наиболее важный фактор мышечного роста. Хотя метаболиты образуются при упражнениях с высокой и низкой нагрузкой, вклад рекрутирования двигательных единиц особенно заметен при упражнениях с низкой нагрузкой, учитывая, что большие нагрузки с самого начала рекрутируют больше двигательных единиц для производства большего необходимого усилия (Рис. 1).
По нашему мнению, метаболиты не обязательны для роста, но обеспечивают дополнительное рекрутирование двигательных единиц в результате локального мышечного утомления.
Тем не менее, можно утверждать, что упражнения с ограничением кровотока не активируют столько же высокопороговых двигательных единиц, сколько традиционная тренировка с высокой нагрузкой (см. рисунок 6 у Manini and Clark, 2009). Мы полагаем, более вероятен артефакт объёма нагрузок, чем истинное различие в активации двигательных единиц, а выводы о рекрутировании двигательных единиц объясняются потенциальными ограничениями использования амплитуды поверхностной ЭМГ. Показано, что при утомительных сокращениях некоторые двигательные единицы не только уменьшают частоту активации, но и полностью выключаются, что позволяет восстановиться от утомления (Person 1974). Так как по-прежнему необходимо производить существенное усилие для продолжения выполнения упражнения, утомлённые двигательные единицы передают свои обязанности другим двигательным единицам (под названием замещающие). Это показывает возможность независимой работы контроля двигательных единиц при утомительных сокращениях от общего предполагаемого движения (De Luca et al. 1982; De Luca and Erim 1994), поскольку каждая двигательная единица может проявлять собственные свойства контроля в пуле двигательных нейронов. Подобный индивидуализированный контроль позволил бы двигательным единицам восстанавливаться при продолжительных утомительных сокращениях (Westgaard and De Luca 1999). Примечательно, что такой контроль происходил при изометрических сокращениях разгибателей колена с усилием до 50% МПС, с ещё большими значениями при динамических сокращениях с изменениями моделей движения (Person 1974).
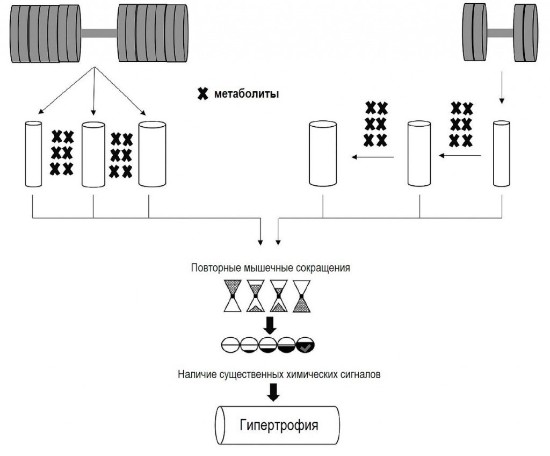
Рис. 1. Несмотря на продукцию метаболитов в упражнениях с отягощениями при низких и высоких нагрузках, они, вероятно, особенно полезны при низких нагрузках из-за способности помочь утомлённым низкопороговым двигательным единицам.
Это приводит к рекрутированию дополнительных двигательных единиц (а значит, и мышечных волокон), не активных в начале упражнения. Нужно отметить, что по нашему предположению метаболиты не являются альтернативным механизмом, запускающим гипертрофию мышц при упражнениях с отягощениями, а предлагают альтернативный способ увеличения мышечной активации. Кроме того, каждое мышечное волокно должно достаточно активироваться в пределах заданной продолжительности упражнений, позволяя механическому стимулу создать достаточный химический сигнал в клетке для инициации гипертрофии мышц.
Явление замещения двигательных единиц (Person 1974) при сравнении протоколов с разными нагрузками объясняет ограниченность выводов о мышечной активации на основе амплитуды ЭМГ. Такие исследования потенциально вводят в заблуждения, так как тренировка с высокой нагрузкой не позволяет замещение двигательных единиц, потому что нужно поддерживать высокое результирующее усилие. Упражнения с низкой нагрузкой до отказа, вероятно, активируют ту же долю двигательных единиц (а значит, и мышечных волокон), что и упражнения с высокой нагрузкой до отказа, хотя это необязательно подтверждается результатами амплитуды ЭМГ (Рис. 2). Другими словами, амплитуда ЭМГ в данный момент времени может быть ниже в упражнениях с отягощениями с низкой нагрузкой, даже при стимуляции аналогичного количества двигательных единиц, и это связано с замещением и последующим выключением некоторых двигательных единиц при записи амплитуды ЭМГ. Для понимания концепции: тренировка с высокой и низкой нагрузкой до отказа приводит к аналогичному уровню активации мышц – мышца неспособна произвести усилие для завершения ещё одного повторения.
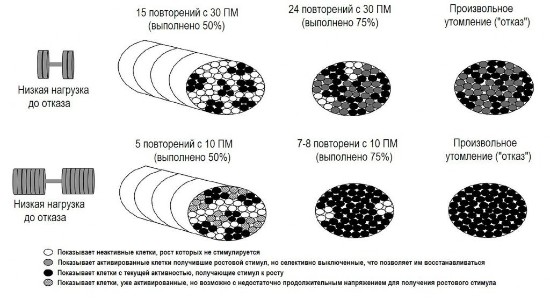
Рис. 2. Волокна, показанные белым цветом, не увеличились, так как не были активированы для запуска каскада механотрансдукции.
Волокна, показанные чёрным цветом, в настоящее время активировались, вносят вклад в производство усилия, и в них будет проходить каскад механотрансдукции, вызывающий мышечный рост. Окраска в чёрную полоску показывает волокна, которые активировались, но не сокращались достаточно продолжительно для индуцирования гипертрофического стимула. Волокна, показанные серым цветом, уже получили стимул к механотрансдукции и увеличатся в размере, но селективно выключены, что позволяет им восстанавливаться. Если подобный протокол оценивается с использованием амплитуды ЭМГ, то уровень активации мышц будет пропорционален количеству волокон, окрашенных чёрным цветом, и белых в чёрную полоску. Это объясняет, почему амплитуда ЭМГ зачастую выше при высоких нагрузках даже при аналогичном количестве волокон, получивших стимул к мышечному росту.
Оценка рекрутирования двигательных единиц при помощи магнитно-резонансной спектроскопии фосфора-31
Альтернативным неинвазивным методом оценки активации мышц является метод магнитно-резонансной спектроскопии фосфора-31 (Park et al. 1987; Vandenborne et al. 1991). Этот метод используется для оценки рекрутирования различных мышечных волокон на основе истощения АТФ, снижения рН и общего содержания фосфатов, а также увеличения концентрации неорганического фосфата. Всё перечисленное происходит при упражнениях, быстрее в волокнах типа II. Важно отметить, что этот метод оценки вклада мышечных волокон в выполнение упражнения менее чувствителен к изменениям интенсивности нагрузки и больше связан с вовлечением мышечных волокон в зависимости от энергетического обмена веществ (Vandenborne et al. 1991). Одна из исследовательских групп применила этот метод для проведения нескольких экспериментов, сравнивающих активацию двигательных единиц при упражнениях с низкой нагрузкой и ограничением кровотока, и упражнений с высокой нагрузкой, а рекрутирование двигательных единиц оценивалось на основе уровня образования неорганического фосфата (Suga et al. 2009, 2010, 2012). При выполнении испытуемыми 60 повторений сгибаний стопы с нагрузкой 20% ПМ, с ограничением кровотока и без него (Suga et al. 2010), показано, что лишь тренирующиеся с ограничением кровотока рекрутировали высокопороговые двигательные единицы. В другом исследовании той же группы учёных не обнаружили увеличения активации мышечных волокон типа II при упражнениях с ограничением кровотока в той же мере, что и в упражнениях с высокой нагрузкой (Suga et al. 2009). Поскольку упражнения с ограничением кровотока (20% ПМ) и с высокой нагрузкой (65% ПМ) выполнялись с аналогичным количеством повторений (60 повторений), потенциал для увеличения массы мышц по-видимому отличался, так как без ограничения кровотока можно выполнить гораздо больше повторений с отягощением 20% ПМ (51 повторение), чем с 50% ПМ без ограничения кровотока (25 повторений) (Barcelos et al. 2015). Поэтому, вероятно, что протокол с ограничением кровотока был не столь утомителен, и величина рекрутирования двигательных единиц фактически недостаточно информативна в этом случае, так как ожидается меньшая потребность в рекрутировании двигательных единиц. В следующем эксперименте этой исследовательской группы сравнивали тренировку с ограничением кровотока и с высокой нагрузкой и получили очень похожие реакции в отношении производства метаболитов и рекрутирования двигательных единиц с более высоким порогом возбуждения (Suga et al. 2012). Поскольку эти протоколы наиболее репрезентативны из большинства использованных протоколов с ограничением кровотока (Loenneke et al. 2012b; Dankel et al. 2016b), вполне вероятно, что оба протокола приводят к аналогичному уровню рекрутированию двигательных единиц/ активации мышц. Описанный метод также имеет ограничения и в будущих исследованиях, возможно, захотят воспользоваться иммуногистохимическими методами с оценкой образцов биопсии мышц, полученных после упражнений, для подтверждения обоснованности этого метода оценки активации мышц.
Какие виды исследований необходимы для определения роли метаболитов в гипертрофии мышц?
Использование модели с электростимуляцией
Высказывалось предположение о возможности тестирования роли метаболитов путём сравнения электрической стимуляции с ограничением кровотока и без него, при отсутствии различий рекрутирования двигательных единиц (Meyer 2006), так как различия в гипертрофии мышц нельзя объяснить различиями в мышечной активации. Несмотря на показанный больший эффект в исследованиях с электростимуляцией в случае ограничения кровотока (Natsume et al. 2015; Gorgey et al. 2016), неизвестно, имелись ли различия в активации мышц, поскольку она не измерялась и оценка затруднена возможностью артефактов, создаваемых колебаниями электрического стимула (Collins 2007). Существуют доказательства роли центральной нервной системы (ЦНС) при электрической стимуляции, так как блокада нерва анестезией (устраняющая влияние ЦНС) приводит к значительному снижению вращающего момента при электростимуляции (Collins 2007). Это участие ЦНС объясняется возможной обратной связью от чувствительных волокон (афферентов групп III и IV) к ЦНС для изменения моторной команды (Laurin et al. 2015) и участие ЦНС, видимо, не зависит от того, применяется ли электростимуляция нервов или брюшка мышцы (Bergquist et al. 2012), но активность двигательных единиц при электростимуляции не соответствует модели упорядоченного рекрутирования, которая обычно наблюдается при произвольных упражнениях (Collins 2007). Вероятно, электростимуляцию можно использовать для оценки роли метаболитов, в случае применения максимальной электростимуляции, при которой нельзя рекрутировать дополнительные двигательные единицы. Следовательно, различия в приросте мышц нельзя будет объяснить различиями в рекрутировании двигательных единиц, хотя этот протокол скорее всего не будет комфортным.
Какие ещё модели можно попробовать?
Для ответа на этот специфический вопрос, исследователям нужно избегать простого наблюдения за уровнем метаболитов при различных протоколах, а вместо этого управлять (через дизайн исследования) контрольной и экспериментальной группой, получающей аналогичный стимул, но с различным производством метаболитов. В нашей лаборатории недавно проведено исследование, в котором мы сравнивали один подход в упражнении до отказа с другим состоянием, где выполнялся тот же протокол, за которым следовало 3-минутное ограничение кровотока для накопления метаболитов в мышце (Dankel et al. 2016a). Поэтому любые различия между состояниями обусловлены вмешательством (трехминутным ограничением кровотока). Стратегия оказалась не только не эффективной для увеличения прироста мышц, но даже негативной, особенно для женщин. Вероятно, из-за накопления метаболитов в мышце после нагрузки (это оценивалось косвенно по уменьшению вращающего момента) у них не было возможности действовать синергически с мышечными сокращениями в последующих подходах упражнения, что опровергает гипотезу о способности метаболитов вызывать гипертрофию мышц независимо от сокращений мышц. Разумеется, мы не можем исключать возможность негативного влияния накопления метаболитов на рост мышц при ограничении кровотока из-за ухудшения доставки питательных веществ (Timmerman et al. 2010). Возможно также, что уменьшение ресинтеза АТФ, накопление АМФ, АДФ и увеличение окислительного стресса от ограничения кровотока без упражнений (Goldfarb et al. 2008; Garten et al. 2015) могло активировать сигнальный путь АМРК, потенциально ограничивая активность mTORC1 и содействуя деградации белка (Atherton et al. 2015). Однако, в нашей ситуации по-прежнему неясны причины половых различий гипертрофии мышц. В будущих исследованиях, направленных на оценку специфической роли метаболитов, необходимо попытаться изменить метаболическую среду в тренируемых мышцах, сохраняя неизменными как можно больше переменных. Кроме того, в экспериментах нужно попытаться оценить независимое влияние метаболитов для ответа на конкретный вопрос: могут ли метаболиты увеличить прирост мышц через механизм, не зависящий от индуцирования мышечного утомления?

Почему упражнения с низкой нагрузкой работают по-другому?
Принимая во внимание идею, высказанную ранее, что рост мышц работает через механотрансдукцию (вызванную сокращениями мышц), изменения механизма, стимулирующего рост мышц при тренировке с низкой нагрузкой, могут показаться нелогичными. Несмотря на это, высказано предположение: «… принимая во внимание низкую механическую нагрузку, возникают сомнения относительно участия процессов механотрансдукции в гипертрофии, вызванной тренировкой с отягощениями с ограничениями кровотока» (Pearson and Hussain 2015). Идея о недостаточности нагрузки или интенсивности при сокращениях мышц во время упражнений с отягощениями с низкой нагрузкой для активации каскада механотрансдукции, очевидно, противоречит текущей научной точке зрения относительно вклада двигательных в производство усилия. Поясним, сила сокращения отдельной двигательной единицы не зависит от величины производимого усилия (например, процент максимального изометрического сокращения) (LeFever and De Luca 1982); таким образом, каждый возбуждённый мотонейрон посылает нервный импульс, который всегда стимулирует иннервированные мышечные волокна к производству максимального усилия. Максимальное усилие отдельных мышечных волокон может отличаться в зависимости от утомления или эффекта Треппе (Тreppe) (небольшое увеличение напряжения при повторных одиночных сокращениях), но они по-прежнему сокращаются с максимально возможной силой. Другими словами, люди могут изменить произвольное усилие за счёт рекрутирования двигательных единиц, но не силу сокращения отдельной двигательной единицы.
Принимая во внимание всегда 100% сократительное усилие в данный момент времени в ответ на каждый стимул, общий стимул для каждого волокна должен зависеть от количества подобных стимуляций. Следовательно, важна не величина усилия, производимого всей мышцей при сокращении, а доля мышцы (процент мышечных волокон), необходимая для производства усилия, так как общая мышечная гипертрофия пропорциональна количеству стимулированных волокон (Marcotte et al. 2015). Таким образом, любой протокол, с высокой активацией мышц и достаточным количеством сокращений каждого мышечного волокна, вероятно, приведёт к активации mTORC1 в пропорциональном количестве волокон, тем самым создавая сходный анаболический стимул. Кроме того, в исследовании, сравнивающем 12-недельные тренировки в разгибании колена с нагрузкой 30% ПМ (с ограничением кровотока) и нагрузкой 6 – 10 ПМ, обнаружили аналогичные срочные и долговременные изменения экспрессии 29 генов, связанных с мышечной функцией без существенных различий между протоколами во всех измеряемых генах (Ellefsen et al. 2015). Это исследование подтверждает наше предположение работе протоколов по аналогичному механизму и затруднений при попытке обоснования точки во всём спектре нагрузки (0 – 100% ПМ), в которой гипертрофический стимул от упражнений с отягощениями переключится с механического на метаболическое управление.
Действительно ли гипертрофия мышц запускается лишь их активацией?
Можно подумать, что активации мышечных волокон при тренировке с отягощениями достаточно для получения механотрансдукции, но лишь активации недостаточно для стимуляции роста мышц. Например, мы провели исследование, в котором у испытуемых каждый день, в течение 21 дня оценивали максимальное произвольное изометрическое и изотоническое (ПМ) усилие, и этого оказалось недостаточно для стимуляции роста мышц (Dankel et al. 2017b). Максимальный характер подобных тестов предполагает, что все двигательные единицы, которые можно активировать, действительно активировались; тем не менее, это не вызвало роста мышц. Следует отметить, когда испытуемые выполняли точно такой же протокол, в дополнение к трём подходам упражнений для противоположной руки, этого оказалось достаточно для стимуляции роста мышц. Совместно эти данные предполагают необходимость для запуска каскада механотрансдукции в каждом волокне не просто активации, но и достаточного количества активированных двигательных единиц с достаточной продолжительностью (достаточное время пребывания под нагрузкой) (Рис. 2). Это может быть связано с недостаточной амплитудой и/или продолжительностью увеличения содержания кальция внутри клетки, поскольку кратковременные/высокоамплитудные кальциевые сигналы активируют путь СаМКII (Chin 2005). Внутриклеточный кальций (Ito et al. 2013) и синтез фосфатидной кислоты (You et al. 2014) также могут ограничить величину роста мышц при столь кратковременных сокращениях мышц, так как эти факторы играют важную роль в начале сигнального пути mTORC1. Вероятно, все факторы, исключающие гипертрофию, связаны со снижением активации сигнального пути mTORC1, поскольку блокирование этого пути отменяет компенсаторную гипертрофию у крыс (Bodine et al. 2001) и значительно уменьшает синтез белка в ответ на упражнения с отягощениями у людей (Gundermann et al. 2014).
Стимула, необходимого для стимуляции роста мышц, по-видимому, нетрудно добиться, так как даже три изометрических сокращения по 10 с в день вызывали измеримую гипертрофию мышц. Мы полагаем, аналогичное количество активных двигательных единиц и равное число активаций каждой двигательной единицы (тот же процент мышечных волокон, сокращаются аналогичное количество раз), недостаточно для стимуляции роста мышц, если эта активация двигательных единиц распределена в течение дня. Другими словами, может ли тридцать изометрических сокращений по 1 с, равномерно распределённые в течение дня, обеспечить результат, аналогичный трем изометрическим сокращениям по 10 с, использованным Ikai and Fukunaga (1970)? Если нет, тогда вероятно нужна не строгая пропорция активированных двигательных единиц и количества их активаций (поскольку они очень похожи в задачах), а достаточное количество активации двигательных единиц определённой продолжительности, необходимой для индуцирования существенных химических изменений, способных вызвать мышечный рост (Рис. 1). Это может быть связано с накоплением фосфатидной кислоты, которая показала решающее значение для механозависимой активации mTORC1 (Hornberger et al. 2006; O’Neil et al. 2009). Сочетание процента стимулированных мышечных волокон и продолжительности стимуляции каждого из них, вероятно, наиболее важные факторы, определяющие гипертрофию мышц, вызванную сокращениями, поскольку в нашей лаборатории показано, что даже максимальные сокращения сгибателей локтя с полной амплитудой движения без внешней нагрузки вызывают гипертрофию мышц, аналогичную упражнениям с отягощениями с высокой нагрузкой (Counts et al. 2016). Несмотря на значительное количество метаболитов, образующихся при длительном нахождении мышечных волокон под нагрузкой, по нашему мнению, роль метаболитов для роста мышц – просто разрешающая и не обязательная.
Выводы
Общеизвестно, что накопление метаболитов при упражнениях с отягощениями – один из механизмов, ответственных за стимуляцию гипертрофии. Для подтверждения этого предположения обычно предлагается факт аналогичного увеличения размеров мышц от тренировки с низкой нагрузкой и ограничением кровотока и тренировки с высокой нагрузкой. В настоящее время неизвестно, проявляют ли метаболиты образующихся при упражнениях с отягощениями анаболические свойства, независимые от мышечных сокращений, или они стимулируют анаболизм через увеличение активации мышц, вызванной мышечным утомлением. На основании имеющихся данных мы считаем, что анаболическая роль метаболитов, образовавшихся при выполнении упражнений, заключается в их способности увеличивать активацию мышц. Для проверки этой гипотезы в будущих исследованиях нужно сравнить два аналогичных протокола, отличающихся лишь наличием, величиной или продолжительностью воздействия метаболитов, с осторожностью, исключающей для метаболитов возможность изменять уровень утомления, возникающего в протоколах.